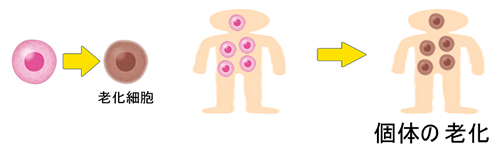
「老化細胞」が体内に蓄積することにより「個体の老化」が起きます。「老化細胞を除去する薬剤の開発に成功」という報告が2020年に日本から3報もありました。東大(GLS1阻害剤、Science)、阪大(ワクチン、Nature)、阪大(BET阻害剤、Nature)。「老化の細胞生物学」は最近、急速に進歩しており、当サイトでも取り上げました(⇒「ポリープは老化するか?」)。科学的な老化防止は培養細胞やネズミの実験系では「現実の物」となって来ています
生物学的老化の定義(2017年のCellのReviewより)
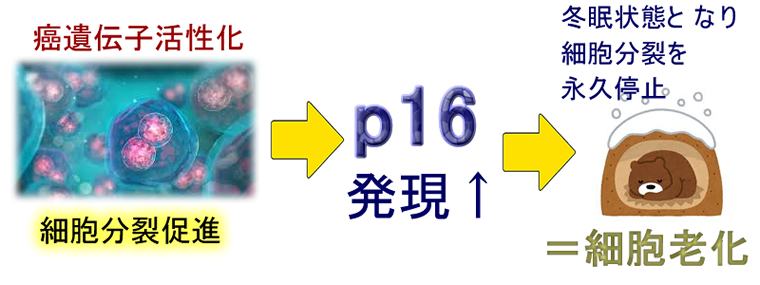
細胞がどの程度、老化しているか?は年齢ではなくて個体のp16(他にp21,p53など)の発現量で決まります。血液のp16を測定することで、個人の老化具合が容易に判定できます。そして「どのような物がp16を増加させる(老化を促進)か、その逆か?」を調べることができます(2014年Reveiw)。タバコ、排気ガス中のベンゼン、紫外線、放射線 、などがp16を増加させる(老化を促進)ことが解りました。結局「発癌物質(=DNAを損傷)」=「老化促進物質」だった訳です。

p16、p21,p53遺伝子が「老化の主犯」で、これらの遺伝子を破壊したマウスでは動脈硬化などの老化が予防されます(2019年)。ここまで読むと「p16やp21,p53は人類の敵、悪玉遺伝子だ!」と思われるでしょう・・・・実は、これらは人で最も重要な「癌抑制遺伝子」です!老化とは癌化を防ぐために細胞分裂にブレーキをかける安全装置だった訳です。
老化細胞除去(Senolysis)の臨床応用は目前。しかし副作用を懸念する意見もある
マウスでは老化細胞除去が癌を予防し寿命を延ばすことが確認されています(2020年Review)。しかしマウスより寿命の長い人では「逆に癌を増やす可能性」も指摘されています(2017年のCellのReview)。除去されて生じたスペースを埋めるために成体内幹細胞が目覚めて細胞分裂を起こすからです。

(専門的)既に抗癌剤として開発されたSenolysis剤があり、人の治験も進んでいる
癌細胞と老化細胞は共通点が多く、細胞死(アポトーシス)誘導型の新しい抗癌剤は老化細胞除去剤にもなります。ダサニチブ(BCR阻害剤)とポリフェノール(クエルセチン)の併用(D+Q療法)が最もよく研究されており、糖尿病性腎症への治験、肺繊維症の治験、が進行中で、他にアルツファイマー、骨粗鬆症など多くの治験が計画されています(2020年Review)。抗癌剤よりも「老化細胞特異的な薬剤」の探求が続いて・・・冒頭の「日本発の3剤の開発」となった訳です。 アンチエイジング
飢餓がアンチエイジングになる!
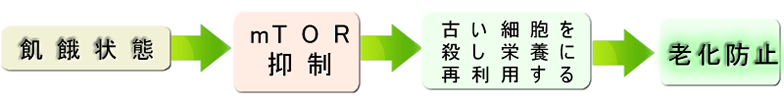
DNAが損傷した細胞を冬眠(老化)させておくよりも殺してしまった方がより安全です。栄養不良状態では、この戦略がとられます。古い細胞を殺して栄養を若い細胞に再利用させるためです。細胞が丈夫で死ななくなったのが「老化」で、細胞が脆弱で死に易くなるのが「若返り」ということになります。「逆説的で解り難い」理論ですが大隅博士がノーベル賞を受賞したオートファジー(自己消化)が、この現象の核心部分になります。
(専門的)メトホルミンがアンチエイジング効果がある
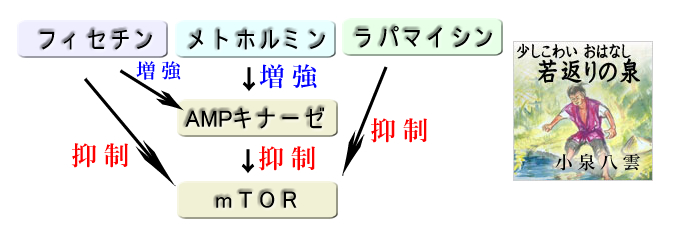
まず運動、カロリー制限(飢餓)は老化を抑制することが確認されました(2014年Reveiw)。更に以下の3剤が「アンチエイジング薬」の候補として見つかり、現在、米国で老化防止の臨床治験が進行中です(2019年Review)。| メトホルミン | 糖尿病治療薬。ポリープ抑制効果も確認された |
| フィセチン | ポリフェノール類フラボノイド(上記のクエルセチンの類縁) |
| ラパマイシン | 免疫抑制剤 |
興味深いことに、この3剤は機序に共通点があります。AMPキナーゼ(=飢餓センサー)を活性化し(疑似的な飢餓状態になる)、mTOR(細胞死を抑制する)を抑制するのです
つまるところ・・・
「アンチエイジング剤とは飢餓応答を利用したマイルドなSenolysis剤である」と言える訳です。
| 前回、「栄養過剰が大腸癌を促進する」という記事を書きましたが、この逆で「飢餓が癌・老化を予防する」という理論が、定説化しています。上記3剤は「疑似・飢餓薬(Caloric Restriction Mimetics)」とも呼ばれます(2020年Review 1,2, 3 )。しかし、当然ですが飢餓は万能薬ではありません。感染症での死亡率は栄養状態が悪いと高くなります。 |
では本題に入ります
大腸ポリープと老化(⇒「ポリープは老化するか?」)
以前に「ポリープはいつ癌化するか?」という記事で平衡破綻モデルを紹介しました。過形成ポリープ(SSAP)の癌化は下図のような経過をとります。
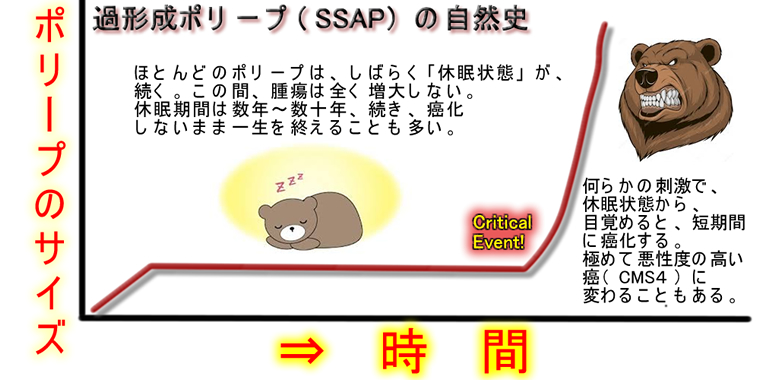
2010年論文「V600EBraf induces gastrointestinal crypt senescence」
この休眠状態にあるポリープ(=日常に内視鏡で観察されるのは、ほとんどが、この段階です)を調べると・・・・p16高値で「老化細胞」であることが解りました。p16が正常に機能すれば、ポリープは癌化しないまま一生を終えます。しかし、何かの理由でp16が壊れると、「老化が解除」され、急速に癌化することも解りました(2010年の報告)。
実は、この現象は大腸に限定せず全身の「良性腫瘍」に適用されます。
| 2005年のNATUREに「多くの良性腫瘍は高率に老化状態にある。これは癌化を防ぐ防御機構である」と報告されました。 |
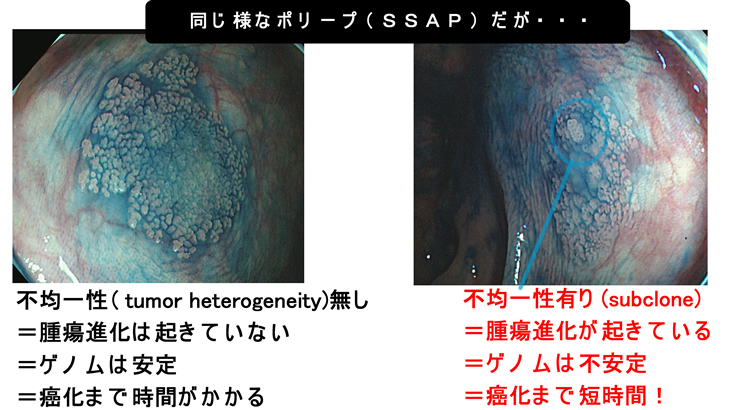
これは「ゲノム不安定性」で紹介した比較写真です。左のSSAPは休眠状態(=老化細胞)ですが、右のSSAPは一部に「休眠からの覚醒(=若返り)」が起きている、とも解釈できる訳です。
Senolysis剤で過形成ポリープ(SSAP)を根絶できるか?
SSAPや過形成ポリープが多発する「重症型SPS症候群」では毎年、内視鏡を施行しても癌の発生を防げず、欧州では予防的大腸全摘手術が、しばしば選択されます(⇒2019年SPS,SSAPの最新情報)。理論的にSSAPは老化細胞除去剤で根治できるはずです。
腺腫は老化していない
多くの報告が「腺腫は老化細胞ではない(p16は高くない)」と断言しています(上記の2010年の報告、1.2)。腺腫は幹細胞マーカーが陽性(⇒「ポリープは老化するか?」)であることから「SSAPは老化細胞。腺腫は胎児化細胞」と言えます
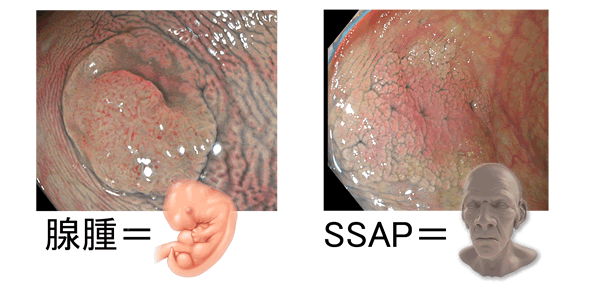
すると、老化細胞除去剤を投与してもSSAPは消えるが腺腫は消えない訳です。これは「重症型SPS症候群」の治療に応用する上で問題になります。「重症型SPS症候群」の方はSSAPだけでなく腺腫も多発するのが常だからです。

以前「10年以内に薬でポリープを治す時代が来る」と書きました。「ポリープの最終解決」まで、まだまだ課題はありそうです・・・しかし人類は「老化細胞除去剤」という新たな武器を手にいれたことは確かです。

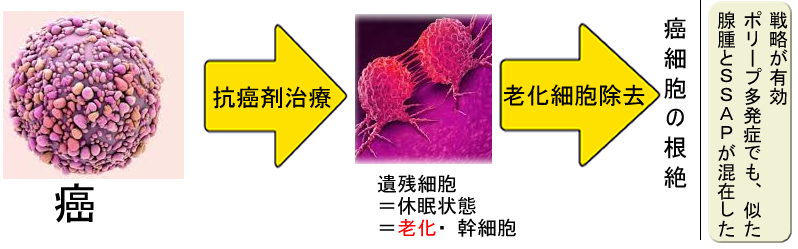
(専門的)「抗癌剤治療後の微少な癌の遺残」に「老化による休眠」が起きていると考えられており、下記のような「2重攻撃」が検討されています(2020年Review 2018年Review)。このような戦略は、将来「腺腫とSSAPが混在・多発する症例」を分子標的薬で根治するという場合にも重要になると思われます。
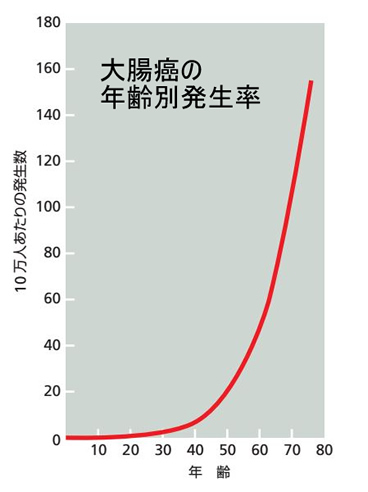
加齢に伴い大腸癌は増える。しかし高齢者はポリープの新規の発生率は低下する
加齢にともない大腸癌の発生率は上がります(下図)。これは遺伝子の異常が蓄積されていくからです。この現象は「大腸癌は多段階発癌でありDe novo型発癌ではない」客観的証拠と見なされています(The Cell 第5版20章p1095)。一方、一見、矛盾する話なのですが、内視鏡でポリープを全て切除した後に「新規にポリープが発生する頻度」は高齢者は低下します。この逆説的な現象は腸の幹細胞の分裂能が低下するためです(2019年文献)。
「高齢者の大腸癌検診をどこまでやるか?」というのは難しい課題です。「高齢者は、極力、1度は大腸内視鏡を受けるべきである。しかし、一度、ポリープを切除したら(クリーンコロン)、若者ほど、ひんぱんに内視鏡を繰り返す必要は無い」という理論が予想されます。
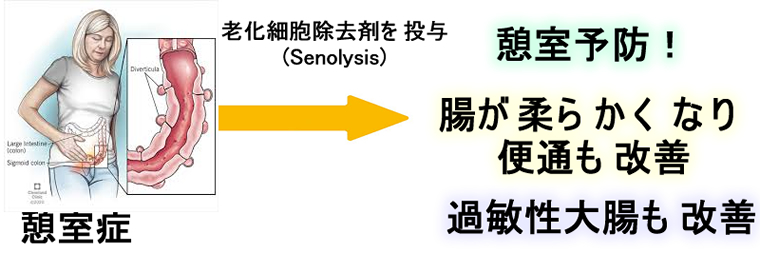
加齢による便秘、憩室はSenolysisで劇的に改善すると思われます
腸の上皮は陰窩幹細胞から新しい細胞が供給されると3日後には絨毛の先端で(老化する前に)死に脱落します。また陰窩幹細胞は老化しません。つまり腸の上皮細胞には「死」はありますが「老化」はありません。しかし上皮の下にある筋肉細胞、神経細胞などの「間質細胞」は逆で「老化」はありますが「死」はありません。つまり「大腸の老化」とは「大腸の間質細胞の老化」なのです。
この現象は特にパーキンソン病で便秘になった大腸で著明です(2018年文献) 2018年文献)。加齢による便秘は現在は下剤、腸の運動促進剤などで対症療法がおこなわれますが、Senolysisは根本的な解決になる可能性があります。
現在、憩室症の根本的治療法はありません。憩室の本態は「穴(くぼみ)」の部分ではなく、腸全体が「繊維化して硬くなり弾力がなくなる」ことにあります(その結果、内圧で腸壁が飛び出すのです)。これは、現在、治験が進行している肺線維症や腎硬化症と同じ病態であり、Senolysisは憩室症の根本的な解決になる可能性があります。
(専門的)ポリープの不完全切除問題を老化の観点から考える
SSAPは、しばしば「不完全切除」が問題になります。テロメアが短縮した老化状態なら不完全切除でも遺残腫瘍は増大できないという理論になります。しかし、SSAPの不完全切除は再発しやすい、というのが臨床的事実です。2018年Natureの理論では「老化解除により腫瘍の悪性度が激増する」とあります。するとSSAPの不完全切除が老化解除を起こす危険性が、問題になります。(専門的)癌化しにくい過形成ポリープが大腸癌死亡の真犯人である理由
過形成ポリープ(SSAP)は腺腫と比較して「癌化する確率は低い」しかし癌化すると悪性度が高く「大腸癌死亡の真犯人(CMS4)」と考えられています(⇒SSAPの二つの顔)。この逆説的な現象は「長い老化(休眠)期間中に腫瘍がチューンアップされる」という報告(2018年Nature 老化は幹細胞化である)で説明可能です。(専門的)腺腫は老化するか?
腺腫と過形成ポリープは逆の性質のように思えますが、そうではなく、実は「幹細胞化」と細胞老化は、表裏一体の現象という、驚くべき事実が報告されています(2018年Nature 老化は幹細胞化である)。共に「不死化・細胞分裂の停止」が特徴ですから当然なのかもしれません。では腺腫に「老化」は起きているか?ですが答えは「YES」でしょう。おそらくRASによりOncogene-induced senescenc(OIS)が起きて、次にp53が不活化して「老化解除」して癌化すると思われます。RASはOISを起こし易く、これは他の多くの癌に見られるパターンです。上記Nature論文では「老化解除にはWNTが鍵」と報告されていますが腺腫は最初からWNTが亢進していますから、老化解除が速いと思われます。