なぜゲノム不安定性が癌の本質なのか?
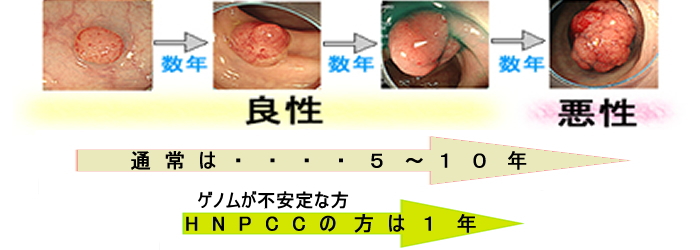
正常な細胞が1回の細胞分裂で偶然の突然変異が起こる確率は10の9乗分の1です。大腸癌は最低でも「5つの遺伝子異常」がなければ発生しません。「DNA修復装置」が正常なら、10のマイナス9乗が最低5回必要で確率的に癌は発生しないはずであると予想されています。「ポリープはいつ癌化するか?」という命題の答えがここにあります(下図)。ポリープの癌化は生物の進化と同じです(腫瘍進化)。正常大腸細胞の寿命は3日ですが、遺伝子の変異が蓄積し生存期間が延びた優位クローンが選択されていき腫瘍(ポリープ)となり癌に至ります。ゲノムが不安定なら、この変異蓄積が速く進行する訳です。
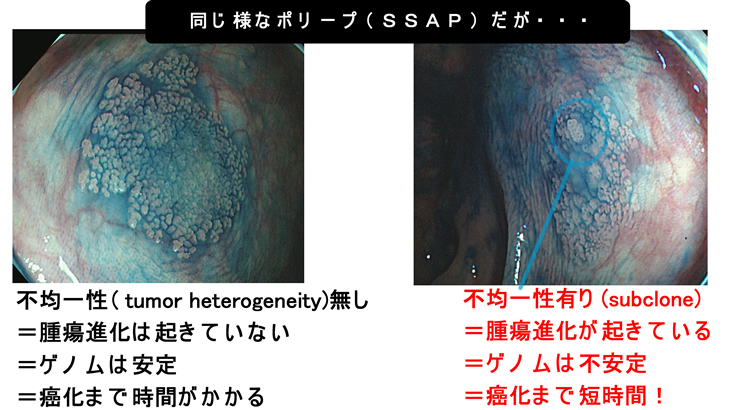
同じポリープ多発症でも腺腫とSSAPの両方が多発する方が最もリスクが高く、腺腫のみ多発、SSAPのみ多発の方は、リスクは意外と高くありません(文献)。「混在して多発」するのはゲノム不安定を意味するからです。
ゲノム不安定化が起こる原因は4つあります (2020年Review)
| (1)生まれつきDNAを修復する 酵素に異常がある |
遺伝性大腸癌(HNPCC)や遺伝性乳癌 その他、多くの「家族性癌体質」はこのタイプ。 |
| (2)細胞分裂が速すぎて修復システムが故障 | 過形成ポリープ、SSAPの癌化はこのタイプ? |
| (3)染色体粉砕(クロモスリプシス) | 最近、提唱された説。細胞分裂時に核外に置き去りになった 染色体が粉砕されて多数の変異が瞬時に導入される現象 |
| (4)ストレスへの応答、細胞が自らゲノムを変異させる | 最近、提唱された説。普遍的な現象かもしれない |
(1)生まれつきゲノムが不安定な方
遺伝性大腸癌と遺伝性乳癌が最も頻度の多い代表的な病態です。しかしゲノムの安定性に関与する遺伝子(Genome Maintenance Gene)は1000以上あり、頻度の低い、未解明の病態が多数、あると予想されています。
| 遺伝性大腸癌 | MLH1遺伝子異常 | マイクロサテライト不安定性(MSI) |
| 遺伝性乳癌 | BRCA遺伝子異常 | 染色体不安定性(CIN) |
遺伝性大腸癌(HNPCC)については当サイトで繰り返し紹介しました(詳しく)が、小ポリープが短期間で癌化するために臨床的に非常に重視される病態です。
(2)細胞分裂が速すぎてトラブルが起こる
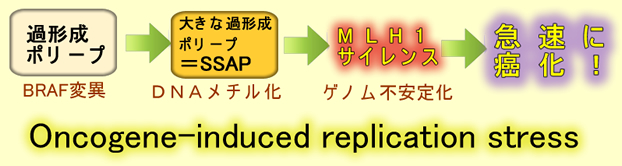
過形成ポリープ(SSAP)の癌化ではMLH1というDNA修復酵素が「サイレンシング(遺伝子が壊れていないのに休眠状態になる現象)」状態になりゲノムが不安定化します。全大腸癌の15%が、MLH1サイレンスが原因です。この現象が何故、起こるのか?これは大腸癌研究の最大の謎の一つですが、最も有力視されている仮説が「細胞分裂が速すぎて、使い過ぎて故障する」というモデルです。具体的には「BRAF変異⇒メチル化異常⇒MLH1サイレンシング(詳しく)」という仮説が出されています。この現象は最近、分子的解明が始まったばかりです(2018年文献、2008年Science)。
「実はMLH1サイレンスは健常な細胞に見られる生理的な現象(個性)である」という説もあります(2019年文献)。これは以下に述べる(3)(4)と似ており「哲学的問題」です。
(3)染色体粉砕について
大腸癌の多くは染色体不安定性(CIN)が見られます。しかし(1)で述べたBRCA遺伝子の異常は見つかりません。大腸癌のCINの機序は重大な謎でした。
ヒトの染色体は46本ありますが、癌細胞では、しばしば「1本の染色体だけが甚だしく異型になる」現象が見られます。これは細胞分裂時に染色体が核外に置き去りになり、変性して、また核内に戻るからです(2015年Nature)。染色体粉砕という現象で「癌遺伝子や薬剤耐性遺伝子の増幅(amplification)」の原因です(2020年Nature)。多くの癌で半数以上の頻度で観察されるます(2020年Nature)が、特に大腸癌は頻度が高く(文献)特に予後の悪いタイプ(CMS4型)で好発します。以上から染色体粉砕が大腸癌の染色体不安定性の機序と予想されています。
染色体粉砕を引き起こす要因として下図の物が挙げられています。癌以外に子宮筋腫のような良性腫瘍にも見つかり、時には「正常な人の全身の細胞」にさえも観察されます(2019年Review)。新しい概念であり、現在、研究が進んでいる分野です。

(4)ストレスへの応答
生物は「変異原性物質から自らの遺伝子を守る」機構を持っているだけでなく、積極的に「自らの遺伝子を変異させる能力=DNAダメージアップ・タンパク(DDP)」を持っていることが細菌で発見されました。・・・その後、人にも同じ物が見つかりました(2019年 Cell)。
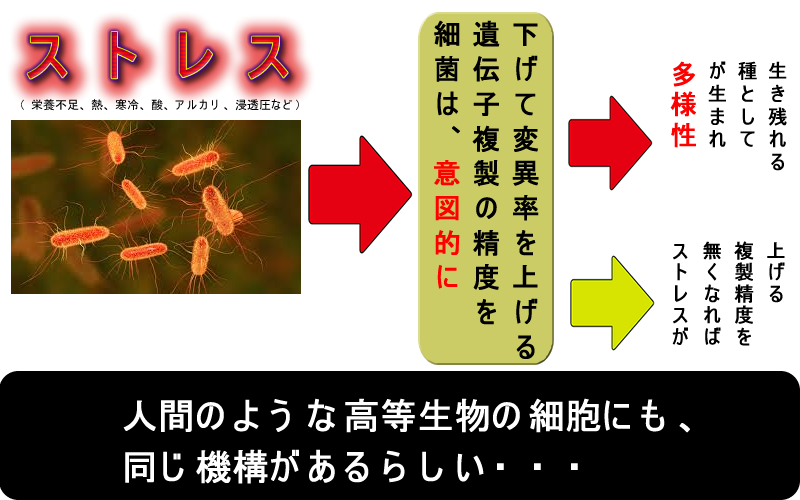
典型的なのは「抗生剤に曝された細菌が変異率を上げて抗生剤耐性菌に変異する」現象で「適応変異(adaptive mutability)」と呼ばれますが、全く同じ現象が分子標的薬で治療を受けた大腸癌にも起こることが解りました。(2019年Science)
ストレスによるゲノム不安定化の分子レベルでの解明が2020年Scienceに報告されました。mTORという細胞の生存(アポトーシス阻止)、成長を制御するシグナルが犯人でした!

更に興味深い報告として・・・
高血圧⇒ゲノム不安定化⇒膵臓癌、という発癌経路が見つかりました!
血圧を上げるホルモン(プロレニン)によりゲノム不安定化が起こり膵臓癌の原因になることが日本のグループから2020年Natureに報告されました。驚くべき報告です。
遺伝性乳癌はBRCAというDNA修復酵素(全身で発現します)の異常で起きますが、何故、乳房特異的なのか?は謎です。有力視されている説が女性ホルモン(エストロゲン)がゲノム不安定化を促進するという仮説です。(2016年文献)
つまり・・・「ストレスやホルモンなどの外的・環境要因によりゲノムの安定性が変わる」という驚くべき現象が明らかになってきた訳です。
以前、腸の細胞が環境の変化に順応して進化する(体細胞進化)という驚くべき現象を紹介しました。 人体で最も細胞回転が速い腸だから、起こりえる、ダーウインも驚愕する現象ですが、我々の細胞は想像以上に「動的」だった訳です
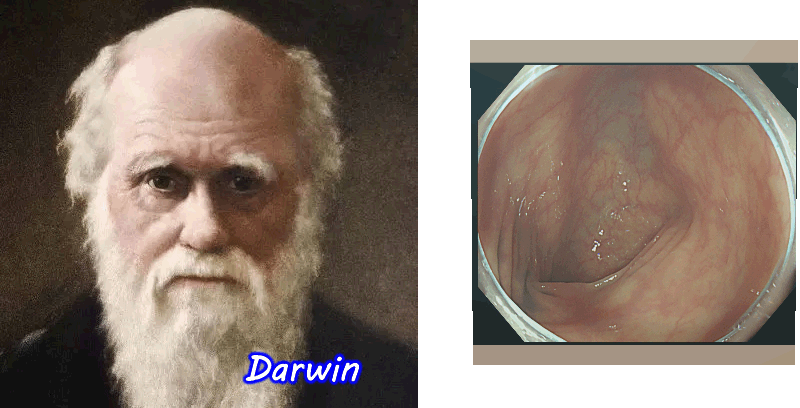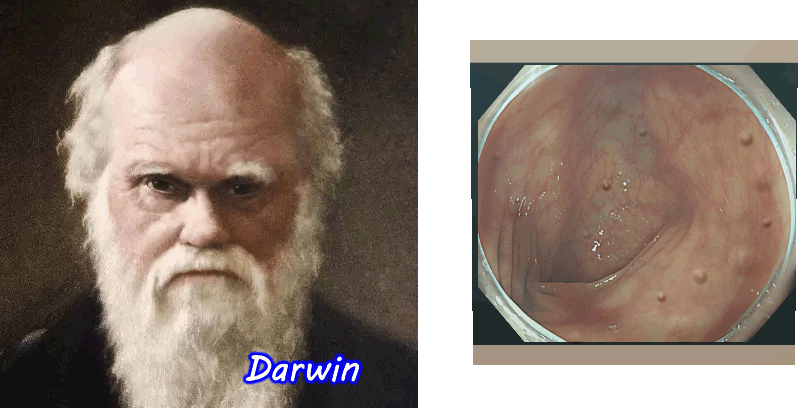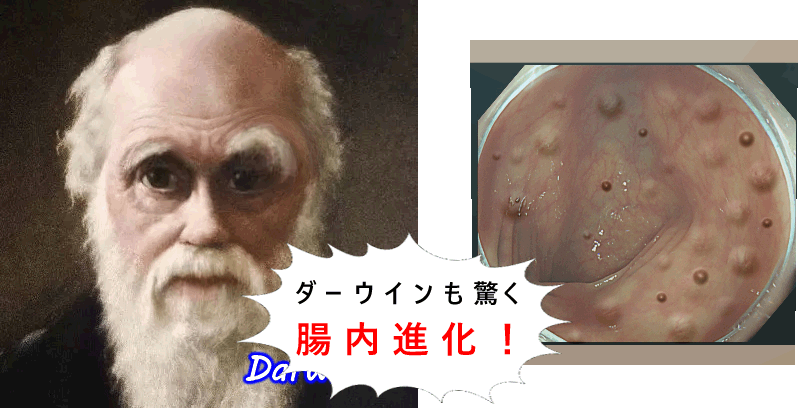
更に最近は以下のような現象も解明されてきました・・・・
| 遺伝子変異を修復する機能が遺伝子変異の原因になるというパラドックス |
The Cell第5章より「遺伝子の変異を抑えるために、我々は膨大な投資をしており、ゲノムの数%はDNA修復酵素である。しかしDNAを修復するということは、すなわちDNAを書き換えることである。適切に作動しないとDNA修復酵素がDNA変異の原因になる」(専門的)DNA修復酵素が強ければ望ましいのか?DNA修復酵素は強すぎてもDNAを変異させ発癌を起こす諸刃の剣です。「DNA修復酵素とはDNAを切断し削り取る酵素」だからです。有名なのが遺伝性乳癌の原因であるBRCA遺伝子で、発現が強すぎると相同組み換えを必要以上に、起こしLOH(ヘテロ性消失)を起こし発癌を促進します。また多くの癌の遺伝子変異、3分の1の人の遺伝病の原因がメチルシトシンの脱アミノ反応で起こる(The Cellp273)が、この脱アミノ反応を起こす酵素は「RNA編集」として、本来は「DNAの変異を補正する」目的で進化したと予想されています(他に抗ウイルスなど諸説あり。The Cell p419 ⇒Apolipoprotein B mRNA editing enzyme catalytic polypeptide‐like family genes)。従って細胞は状況に応じてDNA修復システムのレベルを調整しなければいけないのです(The Cell p273)が、ストレス下で、この調整が破綻することは想像に難くありません |
最後に「哲学」を・・・

(専門的)大腸では、なぜ、ハウスキーピング遺伝子であるDNA修復酵素がサイレンスするのか?(私見)
BRAFによりDNAメチラーゼが誘導されるという報告があります(2009年 2010年 2020年 )。しかしこれはMLH1サイレンスを説明できません。ハウスキーピング遺伝子のプロモーターはメチル化されない(メチル化保護)のが通常であり、なぜ「メチル化保護が解除されるか」を説明できないからです。さて・・細胞には精度よりも速さと融通(多少の不対合は無視)を重視する緊急時用DNAポリメラーゼがあります。 以下は私見ですが。動物にとって大腸内は常に病原体細菌との闘いの場です。細菌により作られた粘膜の傷を至急で修復しなければ死に直結します。DNA複製の正確さを犠牲にする必要性がしばしば起きたでしょう。不対合修復遺伝子のサイレンスは、そのような進化の結果なのかもしれません(専門的)MSI大腸癌にSynthetic lethality治療は可能か?
MSI陽性大腸癌はDNA損傷型の抗癌剤に感受性が高く、MSI-very Highの癌は、むしろ予後が良いという傾向があります。この事実からBRCA欠損癌へPARP阻害剤が有効なように、MLH1欠損癌にもSynthetic lethality治療は有効ではないかか?と予想されます。2019年NatureにWRN helicase(ウエルナー早老症の原因となるDNA修復系酵素)がMSI癌の生存には必須であり(MSS癌は無くても生存できる)、この阻害剤がSynthetic lethalityになる可能性が報告されました)(専門的)DNA不安定性の新しいパラダイム
遺伝的不安定性は癌のアキレス腱であり腫瘍進化では死滅クローンも多く、癌は「実は、かろうじて生きている」と言われます。その生存を支えているのがmTORです。従来は「mTORはストレスによるアポトーシスを抑制して 遺伝的不安定性を定着させる」という位置づけでした。mTORが積極的に遺伝的不安定性を上げる現象(2020年Science)は、mTORが「精度の低い複製装置・DNAポリメラーゼ」を動員して「質よりも速さ、急場しのぎの生存」を図る訳です。これは、DNA損傷時にDNA複製を停止するp53やATMと逆の働きで、新しい細胞内情報伝達系の概念です。一方、プロレニンはクロマチン再構成タンパク(SMARCA5/SNF2H)に作用して 遺伝的不安定性を上げると報告されています(2020年Nature)。クロマチン再構成タンパクは「細胞分化」を制御しており、消化管の癌は分化の異常と関係があることが多いため、広く研究されていました(東大病院HP)が、このような形でDNAの不安定性と関係していたとは、大きな驚きです。
