危険なのは「大きいポリープ」ではなくて「早いポリープ」
日常臨床ではポリープの危険性を予測する時には、サイズが重視されます。これは最も簡単な方法であり「サイズと担癌率(現在、癌である確率)が相関する」という事実があるからです。
一方、内視鏡切除や外科手術で根治されるような癌は予後の良い「ゆっくり型」であり、大腸癌死亡の原因となるのは、それとは別の「急速型」であり、もっと小さいうちから浸潤・転移するのでは?という主張もあります。ポリープを「時間軸」を入れて考えることが重要な訳です。2018年の論文を元に、この問題を解説します。
重要なのは「早さ」。それも細胞分裂の速さでは無くて「遺伝子が変異していく速さ(=ゲノムの不安定性)」
危険なポリープとは何でしょう?昔は「細胞分裂の早いポリープ」と考えられていました。もちろん、それも重要なのですが、現在の分子生物学が最も重視しているのは遺伝子が突然変異を獲得していく速さ(遺伝子の不安定性)です。具体的には細胞分裂の時にDNAを正確に複製する「校正機能の障害」です。ポリープ癌化のステップでは「DNA校正装置の故障」が最も深刻でありCritical Eventと呼ばれます。
大腸癌は最低でも「5つのドミノ」が倒れなければ発生しません(下図)。正常な細胞が1回の細胞分裂で偶然の突然変異が起こる確率は(10の9乗)分の1です。「DNA校正装置」が正常なら、確率的に癌は発生しないはずであり「DNA校正装置の故障」こそが癌化の本質である、というのが現在、主流の理論です。
|
遺伝子工学によるポリープの自然史の解明
ポリープはどのようにして癌に変わるか?長い間、議論されている永遠の課題です。この問題は「人のポリープを放置して観察する」という人体実験をすれば解決しますが、もちろん倫理的にできません。
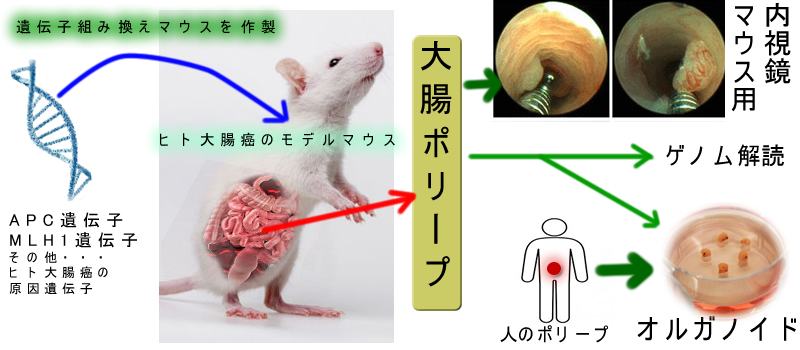
代わりに人の大腸癌の原因となる遺伝子を導入した「遺伝子組み換えマウス」で人の大腸癌発生を模倣するマウスを作り、ポリープがどのように癌化するかを調べるという手法が使われます。
ポリポーシス(APC)、遺伝性大腸癌(MLH1欠失)のモデルマウスが多数、作成され研究者に配布されています。例えば「レントゲン検査で大腸癌リスクが上がるか?」という以前の記事で紹介した研究も、このマウスを使ったものです。大腸癌・モデル・マウスに「極細」の内視鏡を入れて人と同じようにポリープの切除などをすることも可能です。
更に最近は「人のポリープ細胞」から器官培養(オルガノイド)を作り癌化を研究することも盛んです。この分野で、おそらく最も重要なものは「SSAPが大腸癌死亡(CMS4)の真犯人」であることを証明した報告でしょう。
ポリープはいつ癌化するか?提唱されているモデル
古典的 Stepwiseモデル
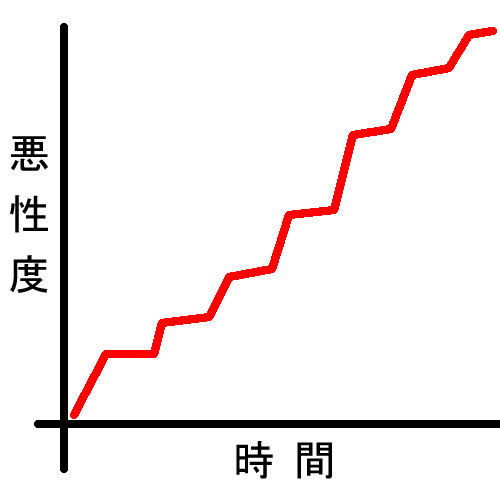
| 第一段階 発生 |
第2段階 成長 |
第3段階 遺伝子不安定化 |
最終段階 癌 |
|
| 腺腫が癌化 するルート |
APC異常 小さな腺腫 |
RAS異常 大きな腺腫 |
p53異常、SCNA(染色体異常) 高度異型腺腫 |
CMS2,3 予後良い、ゆっくり型 |
| 過形成が癌化 するルート |
BRAF、CIMP 小さな過形成 |
p16 Silensing 大きな過形成 |
MLH1欠損(MSI 遺伝子変異集積) SSAP(withDysplasia) |
CMS1 予後悪い急速型 |
英国Morson博士と東大・前教授の武藤博士が1975年に確立した最も古典的なモデルです。(1975年論文)
現在は「Vogelsteinモデル」と呼ばれることが多いのですが、本来は「Morson・武藤モデル」であり、「ポリープが癌の元」であることを世界で最初に主張したのは実は日本の医学者なのです。
「一見正常な粘膜は非常に異常」モデル
ポリープの患者さんの正常粘膜を調べると「癌化に関与する複数の遺伝子」が多数変異していることが解りました。ポリープというのは成長して見えるようになった物を見ているだけであり、実は重要なステップは「一見正常な粘膜」で既に起きているという考えです。現在、最も重視されているのは「DNAのメチル化」という異常です。胃では、この現象が標準です(慢性胃炎⇒腸上皮化生⇒胃癌)。大腸は上の表で「成長」というプロセスがあるのでポリープとして認識されるだけで実は、本質は胃の発癌と同じという考えです。(文献1 2 3 4)。この現象は、特に過形成ポリープ多発症(SPS症候群)で著明であることが注目されています(文献)
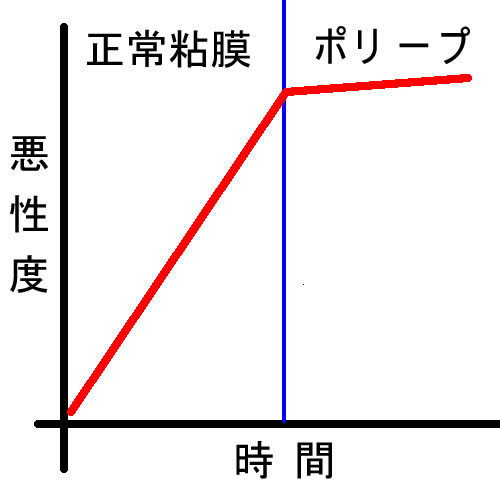
臨床的には・・・
「ポリープが多発する方で切除してもすぐに再発する方がいる」
「最初の内視鏡でポリープが無い方は、その後もポリープが見つかる確率が低い」
などを合理的に説明できます
Born to be Badモデル(Big Banモデル)
危険なポリープは生まれた時から危険であるというモデルです。小さな腺腫の全遺伝子を調べると「APCしか変異していない本当に初期の腺腫」と、小さいのに「RAS異常や染色体異常、他の遺伝子異常が見つかる進行した腺腫」があることが解りました(文献 1 2 3)発生して、最初の数回の細胞分裂期に遺伝子異常を集積する様子はBig Banを連想させます。
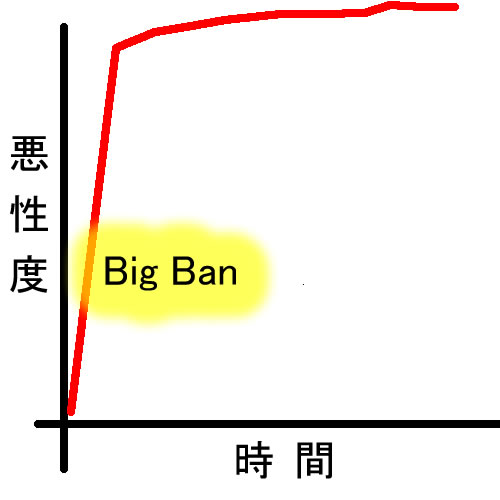
臨床的には・・・
「微小なポリープが癌化していた」一方「かなり大きくなっても癌化しないポリープがある」
という現象を合理的に説明できます
そして平衡破綻モデルへ・・・
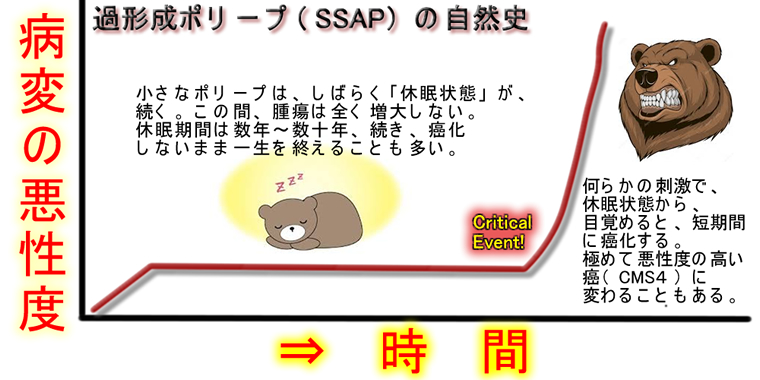
現在、最も有力視されているモデルです。最初のBig Banの後にポリープは長い冬眠状態に入ります。そして「2度目のBig Ban(Critical Event)」で急激に癌化するというモデルです。最初のビッグバンのあと「癌抑制遺伝子(p16,p53)」が作動し細胞は「アクセルとブレーキの両方を全開」にした状態で平衡を保ちます。
しかしブレーキが故障すると2度目のBig Ban(Critical Event)を迎えます
Critical Eventとして重視されているのが「p53の欠損」「p16の欠損」「MLH1の欠損」です
2度目のBig Banは最初のBig Banに比べて、極めてCriticalです。何故ならブレーキ(癌抑制遺伝子)はDNA複製・校正装置と深い関係があり、この故障は「短期間での遺伝子変異の蓄積(不安定なDNA)」を引き起こすからです
2010年論文「V600EBraf induces gastrointestinal crypt senescence」
臨床的には・・・
「多くのポリープは放置しても増大しないのに、たまたまポリープを1個、放置したら短期間で癌化した」という現象を合理的に説明できます
このようなモデルは、最初に「ホクロ」で確立されました。ホクロは最初のBig Ban(RAF遺伝子変異)の後「長い休眠状態体」に入り、第2のBig Banにより悪性黒色腫に変わります(2005年論文)。
そして大腸の過形成ポリープも「ホクロと全く同じ遺伝子変化(RAF⇒テロメア短縮⇒p16⇒分裂停止⇒p16 Silencing)」を経て癌化することが2010年に報告されたのです。
そして上記の2018年の論文ではこのモデルを腺腫にも拡大しています。長い休眠期に多様な遺伝子異常が集積する。これにより腺腫内に多様性(多クローン性、不均一性)が生まれるというモデルです
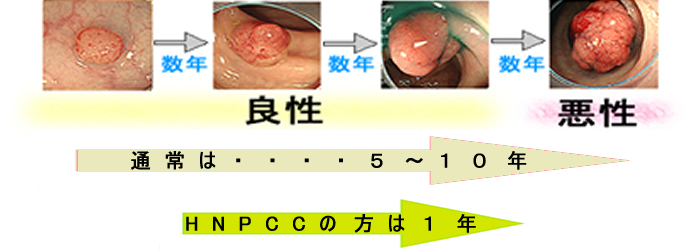
ホクロはいつ癌化するか?・・・・ゆっくりのことが多いが早い人もいる。
これは最近、注目されている問題です。HNPCC(遺伝性大腸癌)の方は遺伝子修復機能に障害があります。そのため遺伝子不安定性が高く、通常は小ポリープは癌化するのに10年かかるのに、1年で癌化してしまうのです。
大腸癌の15%はHNPCCタイプ(CMS1)であり、「HNPCC的な体質(軽症型HNPCCとも言えます)」は決して稀ではないのです。逆に「高齢でポリープが多発しているのに癌にならない方」は遺伝子が非常に安定な体質と予想されます。
「早く癌化するポリープはどのような形態か?」についてはかなり解ってきました(平坦・陥凹型や腫瘍内にサブクローン性が見られるものが危ない)
では、それは、どのような体質の人に発生するのか?予見することは可能か?これが現在の重大な問題です
最近、提唱されているのが「まず最初に遺伝子スクリーニングをしてHNPCC的な体質か否かを調べるのが合理的」という考えです。欧米では手術対象となる大腸癌では、このようなスクリーニングが始まっています(ユニバーサル・スクリーニング)が・・・・・「簡易的な検査(MSI検査)」しかできません(実は対象となるゲノム修復遺伝子は1000個近くあり、MSS型HyperMutated CRCも多くMSI検査の意義は疑問視されています)。いずれにしても、ポリープの段階で全員を調べるのは、まだ先の話になりそうです

