偟偐偟丄偙偺尨懃偵摉偰偼傑傜側偄曽偨偪偑偄傑偡丅億儕乕僾偑彮側偄偺偵戝挵娻偑撍慠丄敪徢偡傞曽偨偪偱偡丅偳偆偟偰丄偦偺傛偆側尰徾偑婲偙傞偐丠偲偄偆偲乽堚揱巕偺廋暅婡擻乮MLH1)乿偑庛偄偨傔偵丄捠忢傛傝傕抁婜娫偱堚揱巕偺堎忢偑拁愊偝傟偰偄偔偺偱偡丅偦偺寢壥乽旝彫側億儕乕僾偑抁婜娫乮侾擭慜屻乯偱娻偵曄傢傞乿偙偲傕婲偒偊傑偡丅
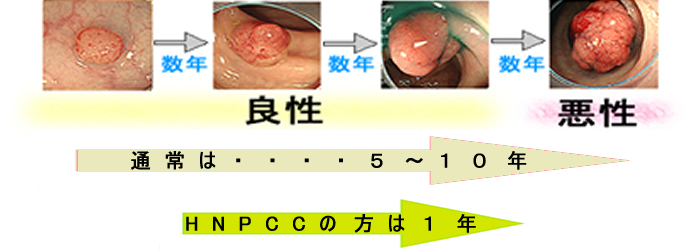
摉弶丄偙偺傛偆側曽偨偪偼乽堚揱惈戝挵娻丄HNPCC丄儕儞僠徢岓孮乿偲屇偽傟丄乽慡戝挵娻偺侾亾乿偑奩摉偡傞偲峫偊傜傟傑偟偨丅偟偐偟嵟嬤偼丄乽堚揱巕偺廋暅婡擻掅壓亖MLH1寚懝偑尨場偺戝挵娻乿偼乽慡戝挵娻偺侾俆亾乿傪愯傔傞偙偲偑夝傝乮CMS1丂徻偟偔乯丄尩枾側儕儞僠徢岓孮偱偼柍偄偺偱偡偑丄偙傟偵椶帡偟偨懱幙乮亖堚揱巕偑曄堎偟傗偡偄丄Unstable Genome乯偺曽偨偪傪乽HNPCC condition乮HNPCC忬懺乯乿乽Lynch-like syndrome乿偲偄偆奣擮偱懆偊傞偲偄偆峫偊偑庡棳偵側偭偰偒傑偟偨丅椪彴揑偵偼乽寉徢宆HNPCC乿偲傕尵偊傑偡丅
偄傢備傞乽娻懡敪壠宯乿乽戝挵娻懡敪壠宯乿偺曽偺懡偔偑HNPCC忬懺偱偁傞偲峫偊傜傟偰偄傑偡丅暷崙彈桪偺庤弍偱儅僗僐儈偱榖戣偵側偭偨乽堚揱惈擕娻乮BRCA曄堎乯乿傕HNPCC忬懺偺斖醗偵擖傝傑偡乮暥專乯丅BRCA傕堚揱巕廋暅偵娭偡傞堚揱巕側偺偱偡偑丄幚偼乽憻婍摿堎惈乿偼丄偁傑傝柍偔乽堚揱惈擕娻偺壠宯偵戝挵娻偑敪徢偟堈偄乿乽堚揱惈戝挵娻偺壠宯偵擕娻偑敪徢偟堈偄乿偙偲傕夝偭偰偄傑偡丅
偙偺曽偨偪偼撪帇嬀傪庴偗偰傕乽億儕乕僾偑柍偄丅戝挵娻偺婋尟偼掅偄乿偲敾掕偝傟傞婋尟偑偁傝傑偡丅偟偐偟HNPCC忬懺偺曽偼丄億儕乕僾偑彮側偔偲傕丄婔偮偐偺廳梫側摿挜乮HNPCC僷僞乕儞乯偑偁傝傑偡丅偙傟偼丄宱尡傪愊傫偩堛巘偱側偄偲敾抐偼旕忢偵擄偟偄偺偱偡偑丄HNPCC僷僞乕儞傪妋擣偟偨傜丄崅惛搙撪帇嬀乮High Quality Colonoscopy乯傪巤峴偟姵幰偝傫偵乽抁偄婜娫偱偺愊嬌揑側娻専恌傪姪傔傞乿偲偄偆懳嶔偑廳梫偵側偭偰偒傑偡(暥專丂暥專乯丅
尒偊偰偒偨旝彫娻乮嘦們娻乯偺惓懱
捠忢丄戝挵娻偲偄偆偺偼乽備偭偔傝宆乿偱丄億儕乕僾偑俀們倣傪挻偊偨偁偨傝偐傜娻壔偟傑偡丅偟偐偟丄悢儈儕偺旝彮側僒僀僘偐傜娻壔偡傞僞僀僾傕偁傝丄擔杮偱偼乽嘦們宆乮De vovo宆乯乿偲屇偽傟寈夲偝傟偰偒傑偟偨丅態庮惉暘傪娷傑偢丄塃懁寢挵偵傛偔尒傜傟傑偡丅
HNPCC偺曽傪撪帇嬀偱尩廳偵宱夁娤嶡偟偨寢壥丄HNPCC偺曽偵敪惗偡傞娻偼乽嘦們宆乮De vovo宆乯乿偑懡偄偲偄偆偙偲偑夝偭偰偒傑偟偨丅乮暥專侾丂暥專俀丂 暥專3丂暥專4乯偮傑傝堚揱巕廋暅婡擻偑掅壓偟偰偄傞偨傔DNA偺曄堎偑抁婜娫偵拁愊偝傟傞偨傔偵旝彫側抜奒偱娻壔偡傞栿偱偡丅
崱傑偱曬崘偝傟偨乽嘦們宆乮De vovo宆乯乿偼乽枹恌抐偺HNPCC偺曽乿偵敪惗偟偨昦曄偑懡偄偺偱偼側偄偐偲悇應偝傟傑偡
偟偐偟HNPCC偱偼側偄堦斒偺曽偵傕乽CMS1乮HNPCC宆乯戝挵娻乿偑敪惗偟傑偡丅偦偺傛偆側乽CMS1戝挵娻乿傕弶婜偺巔偼嘦們宆乮De vovo宆乯側偺偱偁傠偆偲悇應偱偒傞栿偱偡丅
乽娻偼懡抜奒偺宱夁偱敪惗偡傞乿偲偄偆偺偑尰戙暘巕惗暔妛偺揝懃偱偡丅乽嘦們宆乮De vovo宆乯乿偵傕昁偢慜娻昦曄偑懚嵼偟傑偡
偱偼丄乽嘦們宆娻乮De vovo宆乯乿偺慜嬱懱乮椙惈億儕乕僾乯偼丄偳偺傛偆側暔偱偟傚偆丠
CMS1戝挵娻偵偼堚揱巕晄埨掕惈乮儅僀僋儘僒僥儔僀僩晄埨掕惈亖MSI乯偑尒傜傟傑偡丄傑偨BRAF偑曄堎偟偰偄傑偡
億儕乕僾偺拞偱傕態庮傗捈挵丒S帤寢挵偺夁宍惉億儕乕僾偵偼儅僀僋儘僒僥儔僀僩晄埨掕惈乮亖MSI乯傗BRAF曄堎偼尒傜傟傑偣傫乮戙傢傝偵RAS偑曄堎乯
怺晹寢挵乮塃懁乯偵敪惗偡傞夁宍惉億儕乕僾乮Proximal Hyper乯偼彫偝側傕偺偱傕BRAF曄堎偲CIMP乮儅僀僋儘僒僥儔僀僩晄埨掕惈偺尨場偲側傞曄壔乯偑崅棪偵尒傜傟傑偡
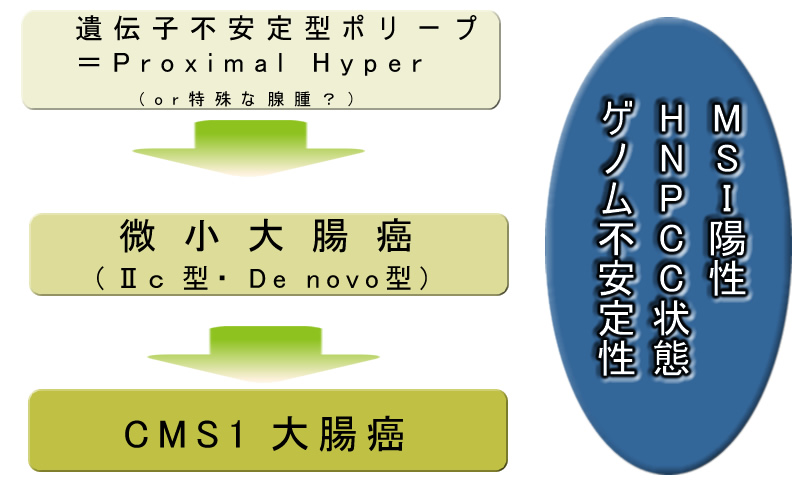
偙偺偙偲偐傜Proximal Hyper偑CMS1偺尦偱偁傞偲偄偆偺偑丄尰嵼偺掕愢偱偡丅偮傑傝Proximal Hyper偑嘦們宆乮De vovo宆乯偺尦偲悇應偝傟傞栿偱偡
峏偵廳梫側偙偲偼Proximal Hyper偼椙惈偺抜奒偐傜怹弫偡傞惈幙偑偁傞乮EMT丂徻偟偔乯偲偄偆帠幚偱丄偙傟傕乽嘦們宆乮De vovo宆乯乿偺廳梫側摿挜偱偡
(堦曽丄乽堚揱巕晄埨掕惈偑偁傞態庮乿傕懚嵼偑妋擣偝傟偰偄傑偡乮MLH1寚懝宆態庮 暥專1丂暥專俀乯丅丄偙傟偑嘦們偺婲尮偱偁傞壜擻惈傕巆傝傑偡丅乯
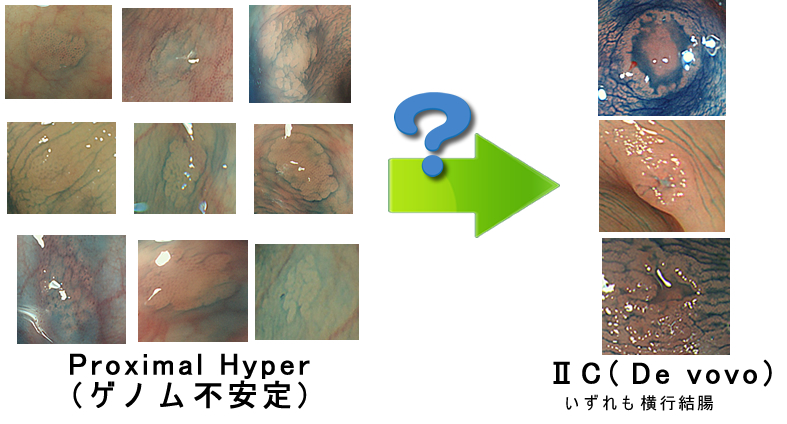
尰嵼丄Proximal Hyper乮塃偺夁宍惉億儕乕僾乯偺婋尟惈傪傔偖偭偰偼愱栧壠偱尒夝偑暘偐傟傑偡
Proximal Hyper偑乮椺偊旝彫側暔偱傕乯尒傜傟傞曽偼丄懠偺晹埵偵戝挵娻偑尒偮偐傞昿搙偑崅偄偲曬崘偝傟偰偄傑偡
偱偡偐傜Proximal Hyper偑丄姵幰偝傫偑乽懱幙揑偵堚揱巕偑曄堎偟傗偡偄乮HNPCC忬懺乯乿傪丄偁傞掱搙帵嵈偡傞偙偲偼娫堘偄側偄偱偟傚偆
暷崙偺僈僀僪儔僀儞偼乽Proximal Hyper偼旝彫側暔傕慡偰愗彍偡傋偒乿偲側偭偰偄傑偡偑丄偙傟偼CMS1娻傪憐掕偟偨偨傔偱偡乮徻偟偔偼偙偪傜傪乯
椺偊旝彫側暔偱傕塃懁偺夁宍惉億儕乕僾偼CIMP偲屇偽傟傞僎僲儉慡懱偵媦傇堎忢偑崅棪偵尒傜傟傞偙偲偐傜乽態庮傛傝傕婋尟側昦曄偱偁傞乿偲偄偆峫偊偱偡
慡偰偺旝彮側Proximal Hyper偑僴僀丒儕僗僋偐偲尵偆偲偦偆偱偼偁傝傑偣傫丅嵟嬤偺懡偔偺曬崘偐傜埲壓偺傛偆側撪梕偑僐儞僙儞僒僗偵側傝偮偮偁傝傑偡
亀態庮偺傒偑敪惗偡傞曽傗丄Proximal Hyper偺傒偑敪惗偡傞曽偺儕僗僋偼丄崅偔側偄丅態庮偲Proximal Hyper偑崿嵼偟偰敪惗偡傞曽偺儕僗僋偑崅偄丅摿偵崅搙堎宆態庮偲SSAP偺椉曽偑敪惗偟偨曽偼堚揱巕偺晄埨掕惈偑嵟傕嫮偔丄儕僗僋偑嵟傕崅偄乮HNPCC忬懺乯丅偦偺傛偆側曽偵敪惗偟偨昦曄偼旝彫偱傕婋尟偱偁傞丅亁乮暥專乯丅
| 戞堦抜奒 敪惗 |
戞俀抜奒 惉挿 |
戞俁抜奒 堚揱巕晄埨掕壔 |
嵟廔抜奒 娻 |
|
| 態庮偑娻壔 偡傞儖乕僩 |
APC堎忢 彫偝側態庮 |
RAS堎忢 戝偒側態庮 |
倫俆俁堎忢丄SCNA乮愼怓懱堎忢乯 崅搙堎宆態庮 |
CMS俀丆俁 梊屻椙偄丄備偭偔傝宆 |
| 夁宍惉偑娻壔 偡傞儖乕僩 |
BRAF丄CIMP 彫偝側夁宍惉 |
p16 Silensing 戝偒側夁宍惉 |
MLH1寚懝乮MSI丂堚揱巕曄堎廤愊乯 SSAP(withDysplasia) |
CMS1 梊屻埆偄媫懍宆 |
