CMS4とは・・・・・大腸癌死亡の真犯人
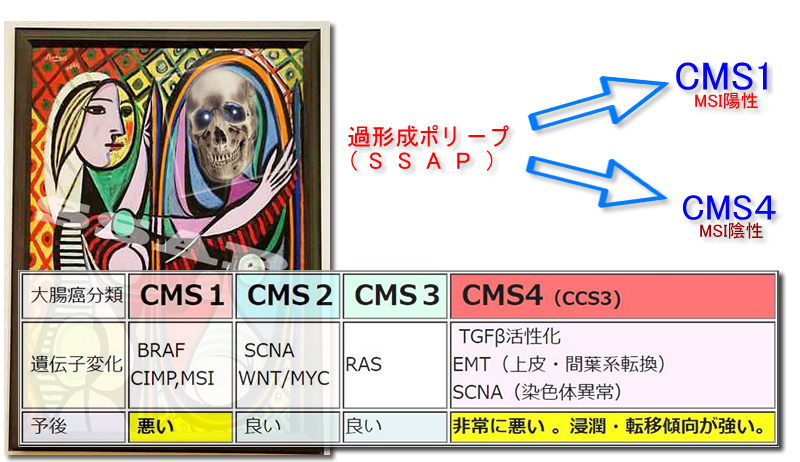
大腸癌は4タイプ(CMS1〜4)に分類されます。このうち、予後が悪いのが1と4で、特にCMS4が断トツで悪いタイプです。
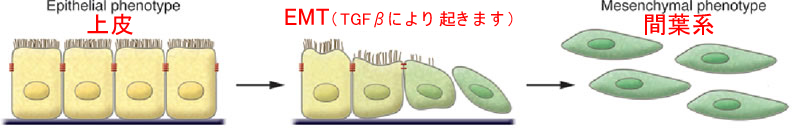
CMS4の特徴はTGFβが活性化され、EMT(上皮・間葉転換 下図)が起き、上皮細胞が動き回るようになるということです。このような性質の癌で代表的なのは膵臓癌とスキルス胃癌です。つまり一般に予後が良いとされている大腸癌の中に「膵臓癌やスキルス胃癌と同じタイプ」があり、これがCMS4(大腸癌死亡の真犯人)なのです
CMS4の起源は何か?
CMS1が過形成ポリープ(SSAP)由来であることは、ほぼ間違いありません。「右側、マイクロサテライト不安定性(MSI)、MLH1サイレンス(HNPCC)」と関係のある癌です。
そしてCMS4の起源もまた過形成ポリープ(SSAP)が有力視されているのですが・・・
「SSAP⇒CMS4」の経路は2013年に最初に報告されました(この論文ではCCS3と呼ばれています)。CMS4とSSAPの遺伝子発現パターンが類似しているという報告です。2015年には、CMS4の性質は癌細胞自体ではなく癌周囲の間質細胞によるという報告がありました。この論文で「間質細胞混入の問題」がクローズアップされました。2016年には(反論するために) CCS3を報告したグループが培養細胞(オルガノイド)を使いSSAP(BRAF変異細胞)⇒CMS4進行は分子生物学的に間違いなく、TGFβが重要であると報告しました。しかし、その後は、「CMS4の起源の問題」を扱った研究報告は無く、棚上げ状態が続いています・・・・ 。その理由はCMS4は癌細胞と間質細胞が複雑に交差しており細胞レベルでの研究が困難であるからです。
SSAP⇒MSI陰性癌の研究が突破口になる
「ほとんどの癌はDNA不安定性(MSI)か染色体不安定性(SCNA)のどちらかを示す。しかし、両方を示すことは無い」という重要な性質があります。
つまりCMS4はSCNA(染色体異常)が陽性ですから、MSIは陰性の訳です
「SSAP⇒CMS1」はMSI 陽性ですが、「SSAP⇒CMS4」はMSIは陰性の癌になる訳です
CMS2は腺腫由来であるとされています。また、CMS3はRAS遺伝子が高率に陽性なのでSSAPとは関係ありません(大腸癌の起源)
すると、理論的にSSAP由来のMSI陰性癌はCMS4になる訳です
BRAF変異あり(SSAP由来)でMSIが「陰性」の癌は「非常に予後が悪い」という報告が二つあります。これらはCMS4タイプと思われます
- 2005年に「BRAF変異有り、MSI 陰性の癌は非常に予後が悪い」と報告されました
- 2012年には「BRA変異有り、右側、MSI 陰性の癌は未分化癌、粘液癌、印鑑細胞癌が多く非常に予後が悪い」と報告されました
ではCMS4の何割がSSAP由来なのでしょう?
「過形成ポリープ(SSAP)の多くはBRAF陽性です。CMS4の中でBRAF陽性は10%前後です(文献)。BRAFをマーカーにするとCMS4の大部分は腺腫由来であり、SSAP由来は少ないという結論になるのですが・・・・
SSAPは極めて早い段階で「CMS4化」するらしい
CMS4というのは独立したサヴタイプというよりも「大腸癌の悪性度が最もひどくなった最終形」と捉えられています。
つまり高度に転移する癌は細胞の運動能力が高くEMTが起きているのだから、全てCMS4形質であるという意味です
しかしSSAPは極めて早い段階(良性の段階から!)、CMS4の性質を持っています。ここが腺腫と全く違う重要な点です。
SSAPの遺伝子を調べるとEMTに関係する遺伝子や浸潤に関係する遺伝子(マトリックス・プロテアーゼ)が良性の段階から発現していることが解りました(文献)。一方、腺腫には、このような「CMS4的性質」は全く見られなかったと報告されています。
過形成ポリープが良性の段階から浸潤する現象(Pseudo Invasion)は昔から知られていましたが2019年、「良性SSAPを調べると3分の1に粘膜下層への浸潤(Inverted Growth)が確認される」と報告されました。
これらはSSAPがCMS4の危険な性質を良性の段階から発現していることを意味します。
2019年には、順天堂大学のグループが「SSAP由来の早期癌は腺腫由来よりも転移の危険が高い」と報告しました(文献)
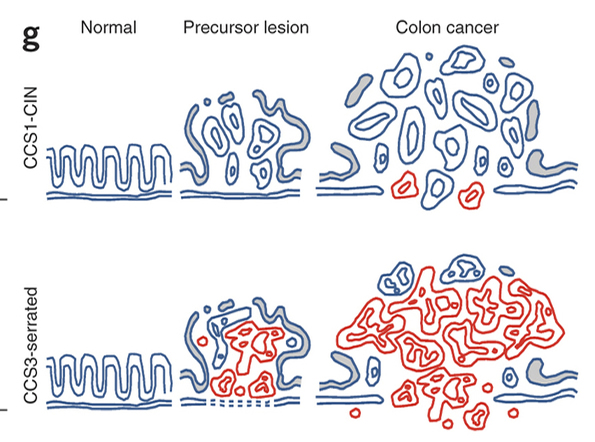
上図が腺腫、下図がSSAP(文献) 赤色がEMTを起こした細胞
「過形成⇒SSAP⇒CMS4」が大腸癌死亡の真犯人のルートか?
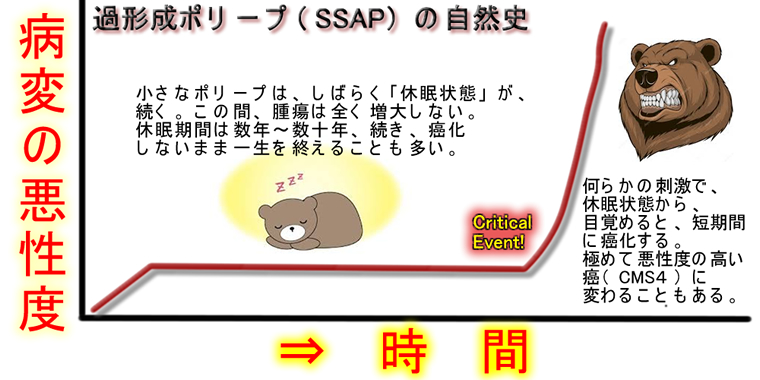
微小な過形成ポリープが大きなSSAPに突然変わるという現象が時に見られます(SPS症候群の患者さんをフォローしていると、しばしば観られます)。上記の理由からSSAP⇒CMS4のステップが急速に起きる場合もあるはずです。つまり、決して頻繁に起こる訳ではありませんが、過形成⇒SSAP⇒CMS4のステップが短期間に起きる場合もある訳です(下図 文献)
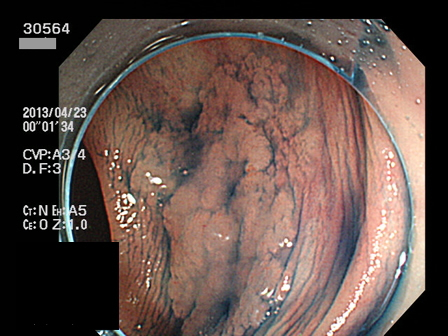
上の写真は「粘膜下層に微小浸潤したSSAP早期癌」で当院でEMRで根治し「ギリギリ・セーフ」でした。しかし、、いつも、このような「幸運」を期待していてはCMS4との闘いには勝てないでしょう。
理論的に・・・・過形成ポリープの段階で「先制攻撃」をすることが「CMS4への必勝の鉄則」になります
しかし先月の「過形成ポリープの取り扱いの問題」でも取り上げましたが、日常の検査では多様な形態の過形成ポリープが多数見つかります。
これらの中には「生涯、無害」な物から「大腸癌死亡の真犯人(将来、早期CMS4に進展するもの)」までが混在している訳です。
先月の記事で取り上げた「右側(Proximal Hyper)を完全切除する」という米国式ルールはCMS1(右側に多い)を念頭に置いたものでありCMS4は考慮されていません
多様な過形成ポリープの中から「真犯人」を鑑別することが可能か?ここが最大の問題になります
危険な過形成ポリープを鑑別できるか?
以下は個人的意見です
日常的に「大きなSSAPの周囲に小型のSSAPが集簇して発生している」という現象がよく観察されます。「腸管内で播種(局所転移)しているのではないか?」と思うことが、しばしば、あります。
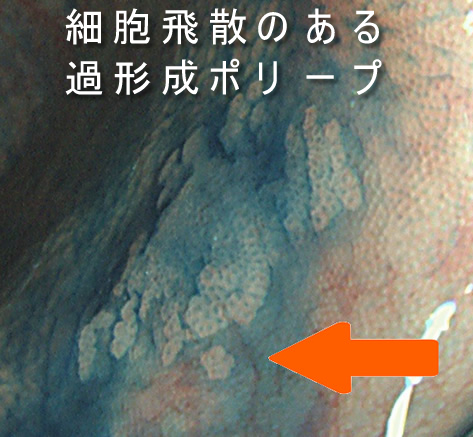
過形成ポリープを詳細に観察すると細胞が「飛散」している所見が時に見られます(腺腫には絶対に見られない所見です)。個人的にはEMTの兆候と考え、2013年に上記の報告を読んでからは、このような過形成ポリープを切除の絶対適応としています。
また患者さんの体質(ゲノムの不安定性)も重要な判断材料になると考えます。不安定性が強い(HNPCC condition)場合は、微小な過形成ポリープも放置すべきでは無いと考えます
CMS4の治療について・・・
最近、欧州でCMS4をグリベックで治療しようという報告があります。グリベックはEMTを阻害するからです。グリベックは慢性白血病治療薬で、「最も成功した分子標的薬」と言われています。このCMS4の治療は対象患者さんの選択から治療判定まで、分子生物学的手法が主役になるという画期的な物です。慢性白血病のような劇的な効果が確認されれば「分子生物学の勝利」を象徴するニュースになるでしょう
CMS1にオブジーボなどの免疫賦活剤が著効するというのも最近の話題であり、「大腸癌の診療は分子生物学の時代になった」と感じます
