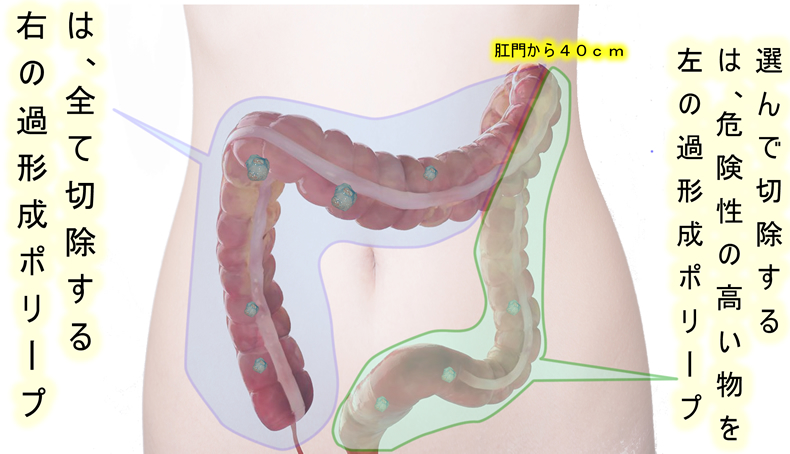
大腸ポリープは「病理学的に」2つに分類されます。腺腫と過形成ポリープです。癌化の危険が高いのは腺腫で、「腺腫を確実にゼロにする」ことが基本です。
一方、内視鏡を受けポリープを切除した方に発生する大腸癌=内視鏡後・大腸癌(Interval Cancer)の多くが過形成ポリープ由来であることが解っており、内視鏡後・大腸癌をゼロにするには過形成ポリープの安易な放置はできなくなります。
この問題を考える上で「過形成ポリープ・癌化の分子生物学的理解」がどうしても必要になります。
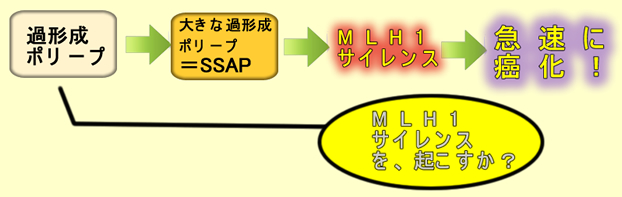
通常は過形成ポリープは大きな病変(=SSAP)になってからMLH1サイレンスという現象を起こし、その後、急速に癌化します。
(MLH1はDNAの変異を修復する酵素で、これがサイレンス状態になると遺伝子変異が加速度的に集積します)
つまりMLH1サイレンスがCritical Eventであり、これが起これば癌化の危険性は極めて高いのですが、起こるのは通常はSSAPに限定されます。
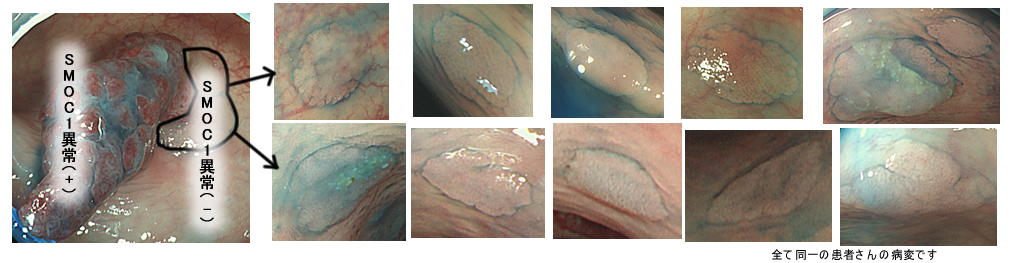
しかしMLH1サイレンスの原因であるCIMPという現象に注目すると・・・小さな過形成ポリープでも、かなりの割合でCIMPが検出されます。つまり小さな過形成ポリープも「潜在的癌化のポテンシャル」を持っている訳で、ここが問題の核心部分になります
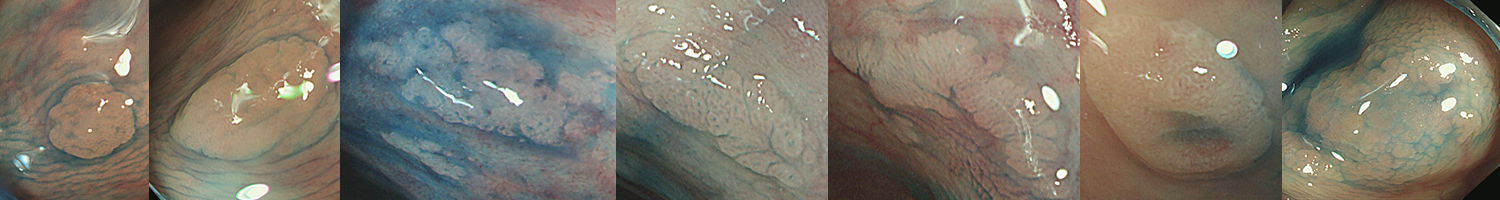
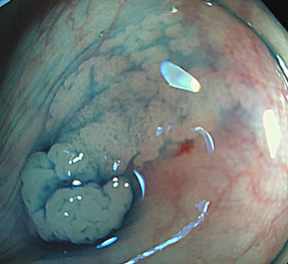
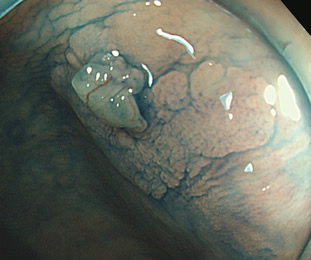
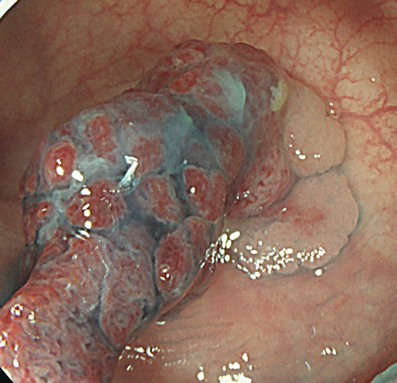
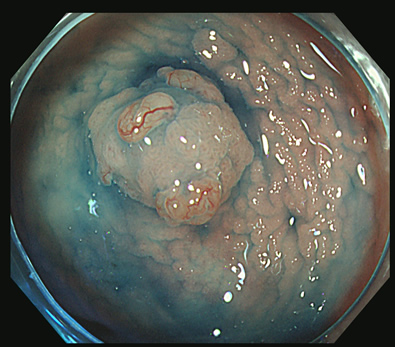
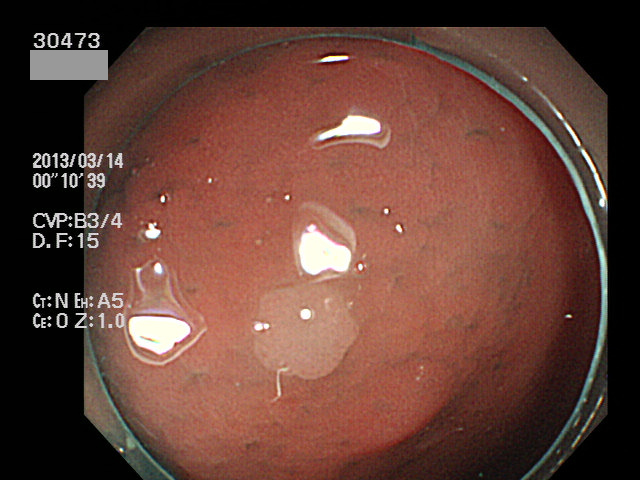
実際の写真です
これを見て「過形成ポリープは色々な形態をしているのだな・・・」と気づかれた方は高い洞察力がある方です。
病理学的に過形成ポリープと診断される病変は、要するに「腺腫では無いポリープの総称」で遺伝子異常は様々であり(RASやRAFが多いのですが、理論的にWNT系以外のあらゆる細胞増殖遺伝子が原因になります)、「その他、大勢」なのです。
便宜上、一緒くたにされていますが「本質は全く違う病変の総称」であり、全く無害なものから、極めて危険なものまで含まれます。