「内視鏡では異常が無いのに、バイオマーカー検査は陽性」という現象は高齢者に多いと2020年に報告されました(文献)。問題視されたのは、「便中DNA検査」と「血中DNA検査(セプチン9)」で、高齢者に施行すると過剰診断のデメリットが大きいので、すべきではないと結論しています。
バイオマーカー検査の意外な落とし穴・・「感度が良すぎて加齢で全員、陽性になる?」
2018年に「便中DNA検査の衝撃」という記事で「内視鏡よりも感度が高いようだ」と書きました。内視鏡で認識できない微小な(見えない)腫瘍が、分子生物学を駆使したバイオマーカー検査で検出される訳なのですが、この事態をどう考えるべきなのでしょう?
「内視鏡では異常が無いのに、バイオマーカー検査は陽性」という現象は高齢者に多いと2020年に報告されました(文献)。問題視されたのは、「便中DNA検査」と「血中DNA検査(セプチン9)」で、高齢者に施行すると過剰診断のデメリットが大きいので、すべきではないと結論しています。
ゲノム解読の高速化により「全身の細胞レベルで全遺伝子を調べる」という研究が最近、行われるようになりました
そして加齢により「一見正常な細胞にも、癌遺伝子の変異が蓄積していく」という現象が、解ってきました(特に皮膚、食道、子宮内膜は遺伝子異常が多いようです)
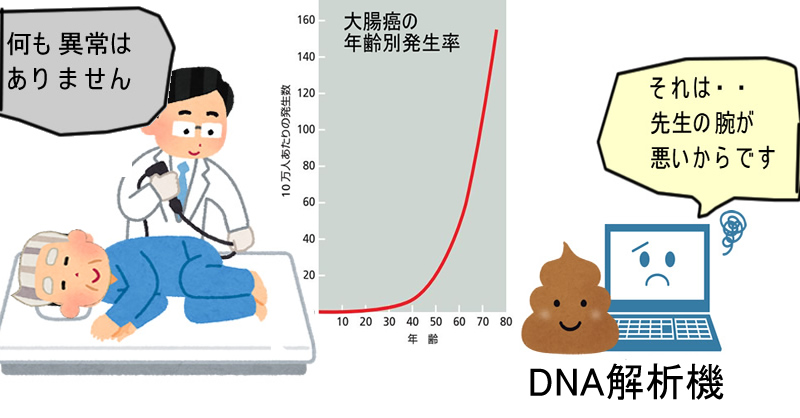
2019年のNatureに「中高年者の正常大腸細胞の1%に大腸癌の発生の鍵である遺伝子異常(ドライバー変異)が検出される」と報告されました
詳しく・・・
加齢に伴い実に多くの遺伝子変異が発生し、高齢者の陰窩(Crypt)の実に85%に何らかの遺伝子変異が検出されます。その多くは「生物学的な意味の小さい変異」です。しかし大腸癌発生に直接、関係のある癌遺伝子異常(ドライバー変異)だけに限って調べても全陰窩の1%に異常が見つかります(ACF=Aberrant Crypt Fociと呼ばれます。厳密な定義は異なるのですが、本文ではACFと呼びます)。我々の大腸に陰窩は約1500万個あるので高齢者は皆、大腸に15万個の微少な前癌病変(ACF)を持っていることになります。これらは全て「幹細胞レベルの遺伝子異常」であり、自然消滅することは無く、仮に「人の寿命が永遠なら」、(理論的に)我々は皆、15万個の大腸癌を発症する訳です
更に・・・調べてみると
(1)小腸にも大腸と同じ割合(1%)で前癌病変(ACF)が見つかります
(2)同じ方法で調べると、皮膚では30%、食道では50%の頻度で前癌病変が見つかります
言うまでも無く、「小腸癌の頻度が大腸癌と同じ」「食道癌の頻度が大腸癌の50倍。皮膚癌は30倍」などという事実はありません。ACFが「大腸癌の究極の開始点」であることは科学的事実なのですが、ACFから癌になるのは、現実的には、ごく一部(計算上、300万分の1)であり、ACFの存在を癌のマーカーにするのは無理がある訳です
しかしバイオマーカー検査(便中DNA検査も血中DNA、RNA検査も)は、ACFもポリープも区別できません(遺伝子異常は同じであり細胞レベルでは違いはありません)から、全て検出してしまう訳です。
では「高齢者のバイオマーカー検査陽性」は無視でいいか?というと、話はそんなに単純ではありません。偽陽性(異常でないのに陽性になる現象)ではなく、「真の陽性(ただし感度が良すぎる)」だからです
大腸癌は加齢により頻度が急激に増加します。しかし高齢になると大腸内視鏡の負担が非常に大きくなります。例えば下剤が原因で脱水となり脳梗塞などの重篤な事故も稀ではありません。「高齢者の大腸内視鏡を制限すべきである」というのが世界的な潮流であり、高齢者でも負担の無い「バイオマーカー検査」には大きな期待が寄せられています。
しかし細胞レベル、遺伝子レベルの異常を検出するバイオマーカー検査が内視鏡などの形態診断よりも「感度が高い」のは、ある意味、当然の話であり、今後は「実用的なレベルまで、敢えて感度を落とす」という研究が必要になるでしょう
大腸癌・ポリープの診断に有効と報告されているバイオマーカーをまとめると以下のようになります。青字の数字は「マイクロRNA」で、例えば21はmicroRNA21の意味です。黒字はDNA(cf-DNA又はct-DNA)です。基本的にPCR検査で行われます。(2020年Nature Reviewより)
良性のポリープ
の発見にも有効癌の早期
発見に有効癌の治療効果
予測に有効生命予後の
予測に有効癌の治療にも
応用されている便で調べる 21,92a,135b
ITG4,SFRP2,Cologuard21,92a,223
SFRP2,VIM,TFPI血液で調べる 21,92a,29a
SEPT9,SFPR221,92a,221
SDC2,SEPT9,H3K27me155,106 HPP1,HLTF 143 正常な腸の粘膜で調べる 137 (潰瘍性大腸炎の場合に有効) 腫瘍細胞で調べる 106,19a
MGMT,TFAP2A31,224
CDKN2A,CHFR,IGF2,
H3K27me2,H3K56ac,H4K16ac143 転移組織で調べる 34a
H3K4me2,H3K27me234a
潰瘍性大腸炎の方の大腸で同じ様な研究ががおこなわれ、非常に興味深い報告が京都大学と慶應大学から2020年のNatureにありました
共に潰瘍性大腸炎の方を調べると「IL17(NFKB)システムが異常になった細胞(陰窩)が多い」という内容です。この遺伝子変異が潰瘍性大腸炎の原因であるという話ではありません。その逆(結果)であるという話です。上記のように大腸の細胞には様々な遺伝子変異が発生しますが、IL17システムに異常が起きた細胞は炎症があっても死滅し難く、「優位クローン」として生存・選択されます。「偶然の突然変異と自然選択で進化が起こる」というダーウインの理論が大腸の中で起きた、という訳です。AIDSやC形肝炎ウイルスなどの「持続感染ウイルス」は、人体で何年もの間に「進化」して病原性を変えていくことが解っていますが、我々の腸の細胞も一生の間に「進化」を起こす訳です。このような現象は「体細胞進化(Somatic Evolution)」と呼ばれます。腸の細胞の寿命は3日で人体で最も短命で細胞分裂が盛んで、炎症のため細胞の交代が激しいために起こりえる現象です。(⇒「ポリープは老化するか?ポリープの幹細胞」)
我々の腸の中で「進化」が起きていることを遺伝子解析で証明した、日本発の、この二つの論文は衝撃的であり、読めばダーウインも驚いたことでしょう・・・・
もちろん、進化といっても細胞にとっては有利でも個体(人間)にとって有利とはいえません。このような「優位クローン出現(体細胞進化)」と発癌との関連は、重要な研究課題です。(ただし、今回見つかったIL17異常は「腫瘍促進的」ではないようです)