
栄養過剰は、大腸癌、乳癌などの「先進国型・癌の増加」と関連が深いのですが、実は、全ての癌の原因になります。これは「栄養過剰が細胞成長システム(IGF/PI3/Akt/mTOR系 詳しく)を活性化するから」です。
癌の原因の内訳
| 原因 | 全ての癌の原因 に占める各因子の割合 |
| 喫煙 | 33% |
| 栄養過剰 運動不足 |
30% |
| ウイルス | 5% |
| 酒 | 3% |
| 紫外線、レントゲン | 2% |
| 職業性発癌物質 | 5% |

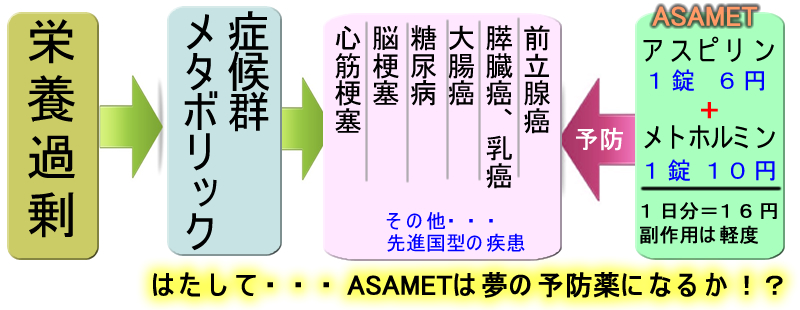
この仮説によりインスリンの有害性が注目され、メトホルミンという「インスリンを低下させる」古い薬が再評価され、抗炎症剤・アスピリンによる癌予防が生まれました。そして、メトホルミン・アスピリン併用療法(ASAMET)の治験が開始しました。
はたして、人類はASAMETで「健康な肥満」を手に入れられるのか?ここが注目されている訳です。
(1)糖尿病治療(インスリン)は発癌を促進する?
糖尿病治療薬にはインスリンを増やす薬と逆に減らす薬があります(下記)。メトホルミンは肝臓での糖の産生を抑え、インスリンを低下させて血糖値を下げます。
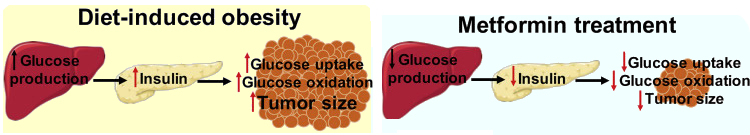
インスリンは体に必要なホルモンですが「細胞成長システムの主役」で発癌にも重要なホルモンなのです。既に血中インスリンが過剰になっている2型糖尿病の方が減量をしないで、インスリン使用量を増やしていくと・・・発癌を促進します!
インスリンは必要だが過剰では有害である
糖尿病治療薬には「インスリン・増タイプ」と「インスリン・減タイプ」があります。
メトホルミン以外にも「インスリンを低下させる糖尿病薬」があります。おそらくは、これらの薬も癌予防効果があると予想されます。しかし、メトホルミン以外は「新しい薬」であるために、その効果を確認できないのです。メトホルミンは「非常に古い薬」で、何十年も服用している方が大勢います。この人たちの「発癌率」を調べることで癌の予防効果が確認された訳です。アスピリンもそうですが、「古い」薬にはメリットが二つあります(1)値段が安い(2)長期服用による人体への影響のデータがある、という2点です。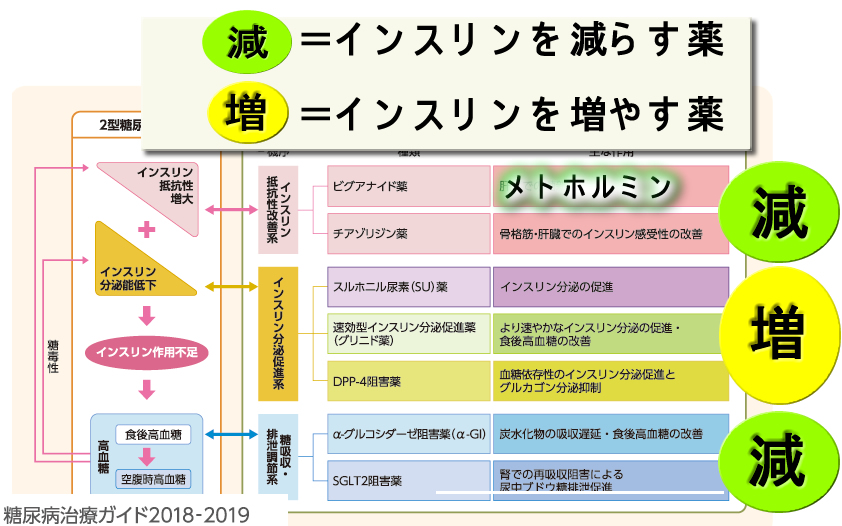
(2)肥満の人は年中、お腹が風邪をひいた状態?
肥満の方は、血液検査で「CRP(炎症で上がるマーカー)」が持続的に僅かな高値を示します。(文献1、文献2)。つまり肥満では軽い風邪の状態が持続している訳です。この理由は脂肪組織が「炎症を起こすシグナル(サイトカイン)を分泌するから」とされています。(2015年 Nature Review)。
皮下脂肪よりも内臓脂肪が炎症を起こし易く、消化器系は内臓脂肪に取り囲まれているために、発癌が起きやすいと考えられています(2017年文献)。メタボは、文字どおり、お腹(消化器系)の病気なのです。
(専門的)肥満は大腸炎を起こすか?
IBDが動物性脂肪の多い西欧風食事と関係することから「肥満はIBDの危険因子なのではないか?」という議論があります。腸管膜脂肪がクローン病と深く関係することを2017年に東大医科研が報告しています。しかし潰瘍性大腸炎は肥満との関連が否定的です(2019年Review)。実験的大腸炎マウスでも「肥満は腸炎を悪化させ発癌も促進する」と報告されています(2018年 2020年)。しかし明白なIBDが無い場合でも肥満は持続的な非・肉眼的な腸炎(≒Microscopic Collitis)を起こしているのでしょうか?肥満がMicroscopic Collitisを起こすか?という疑問については「起こさない」と2019年に報告されています。更にMicroscopic Collitisは大腸癌の危険因子にはならないという報告が2019年に3報もあります(1、2、3)。以上からクローン病では「肥満⇒腸炎悪化⇒発癌」の経路は確定的と言えますが、明白なIBDが無い場合は、その根拠はインスリン説に比べると非常に脆弱と思います。因みにThe Cell第6版では「肥満⇒発癌」をかなり強調していますが、その理由は「IGF/PI3/Akt/mTOR系(インスリン説)」にあると記載し「持続炎症説」には全く触れていません。その他(3)性ホルモン仮説、(4)腸内細菌仮説、があります。
(3)性ホルモン仮説
脂肪組織は男性ホルモンを女性ホルモン(エストロゲン)に変換します。肥満が乳癌や子宮体癌を促進するのは女性ホルモンが高くなるからです。この現象は男性でも見られ、肥満男性はエストロゲンが高くなります。「男性の肥満のエストロゲンが大腸癌を促進する」という仮説が出されました。しかし、「エストロゲンは大腸癌に予防的に働く」という逆の報告も多いです(1,2,3,4)。
エストロゲンと大腸癌
エストロゲンは乳癌・子宮体癌を促進し女性の最大の発癌ホルモンですが「大腸癌を抑制する」というのが定説です。閉経女性が「ホルモン補充療法を受けると大腸癌のリスクは低下する」と多くの報告が結論しています。しかし、時に「エストロゲンが大腸癌を促進している」という報告もあります。このような差異が出る理由としてエストロゲンのレセプターが3タイプ(核内に2、細胞膜に1)有り、各々が作用が異なるからと考えられています。(2019年 2019年 2020年 2020年)。通常タイプの大腸癌・ポリープは「男性に多い(エストロゲンが予防的)」のですが、SSAPは女性に多いことから(2015年文献)、エストロゲンの関与が疑われていますが、2019年報告では「SSAPではエストロゲン受容体は減少している」とあり、この問題は、混迷しています。(3)腸内細菌仮説
最近、肥満と腸内細菌の研究が盛んです(2018年Review)
肥満では腸内細菌の「フィルミクテス門(F)」が増え「バクテロイデス門(B)」が減ります。(F/B)比は肥満と相関して高くなります(2012年報告 2015年日本報告)。「フィルミクテス門(F)」とは、栄養吸収を助けて善玉菌とされる乳酸菌で、(F/B)比が高いほど効率良く栄養が吸収されます。つまり乳酸菌は低栄養状態では「善玉」ですが、「栄養過剰」では「悪玉」になる訳です。このような肥満による腸内細菌の変化が「持続炎症を起こす」というモデルもあります(2018年Nature)。

断食と腸内細菌(F/B)比
時々断食をすることで代謝がりセットされ癌予防にもなるのでは?という意見が2014年のProNAS誌に報告され注目されました。しかし肥満の方が断食をすると腸内細菌の(F/B)比が、更に高くなることが解りました。つまり腸内細菌が低栄養状態に適応する訳です(2017年報告)。この状態で翌日に普通に食べれば・・・・リバウンドします。糖質制限ダイエットは大腸癌を予防するか?
「脂肪制限よりも糖質制限の方が減量効果が大きい」ことから大ブームになりました。糖質制限はインスリンを低くすることで癌予防効果もあると予測されています(2011年 2014年 2020年)。特に糖質をゼロにする方法は「ケトン・ダイエット」と呼ばれ、癌細胞はグルコースを大量に必要とするために「ケトン・ダイエット」により死に易くなります。「進行癌の抗癌剤治療時に、一時的にケトン・ダイエットを併用する」療法の臨床試験が進行中です(2020年Review)。
しかし、糖質制限の結果、脂肪・タンパク質を過剰に摂取すると癌の予防にはなりません。高脂肪・高タンパク食が多くの癌(特に大腸癌と乳癌)を促進することは「確実」で(2015年Nature)、糖質制限とは逆に「たんぱく質制限ダイエット(糖質は自由)が癌を予防する」という報告もあります(2018年Review)。
アミノ酸制限・ダイエット
「脂肪が悪者説」⇒「糖質が悪者説」と変遷し、最後はアンチテーゼのように「タンパク質こそが悪者・説」が最近、出てきました。よく研究されているのはメチオニンなどの「特定のアミノ酸」の制限食です(2014年 2019年)。理論的にタンパク質不足は「細胞数を減らす」効果が最も強力で、アンチエイジン効果が期待されています(次回、取り上げます)が、大腸癌予防効果を調べた報告は、まだありません。
「カロリー制限が老化・発癌を予防する」というのは間違いありません。しかし糖質制限ではなく「糖・脂質・タンパクの全体を制限する」のがベストというのが、やはり正論のようです(2019年 各ダイエットのReview)。以下のダイエットはそのような主旨の物です
地中海食ダイエット
ユネスコが文化遺産に指定した「地中海食」を推奨する研究者は多いです。地中海食が大腸癌を予防することが2013年の大規模調査で確認されました。他のダイエットと比べても「地中海食が大腸癌抑制にベストである」と2016年に報告されました(2017年Review)。原始人食(パレオ・ダイエット)
「我々の体の進化は畜産・農業の進歩に適合していないから原始時代の食事が理想的である」という理論です。牛・豚・羊などの「畜産肉」は禁止、加工食品、乳製品も禁止でダイエットというよりも「教義」に近いもので、魚や貝が貴重なタンパク源になります。「食生活の西洋化で癌が増えたのだから日本人には和食が良い」という意見や、「畜産で量産される牛は健康でなくウイルスに感染している」という意見などと似ています。興味深い理論ですが・・・2020年のメタ解析では他のダイエットと比較して「代謝改善効果は特に優位ではない」という結論でした。原始人食の大腸癌予防効果を調べた報告は、まだありません。「肥満が癌の原因」という仮説は間違いではないのですが、「体質的に太りやすい人がいるのはナゼか?」という問題には答えていません。
広範囲なゲノム解読により「生まれつき太りやすい体質」が同定されました。FTOという遺伝子と、その周辺の複数遺伝子の組み合わせ(=ハプロタイプと呼ばれます)が原因であることが解りました。FTOは「満腹感の閾値」に関係しています。そして「太りやすいハプロタイプFTO=癌になり易いハプロタイプFTO」であることも解りました。つまり肥満を起こさなくても、直接的に癌を促進する体質という意味です。
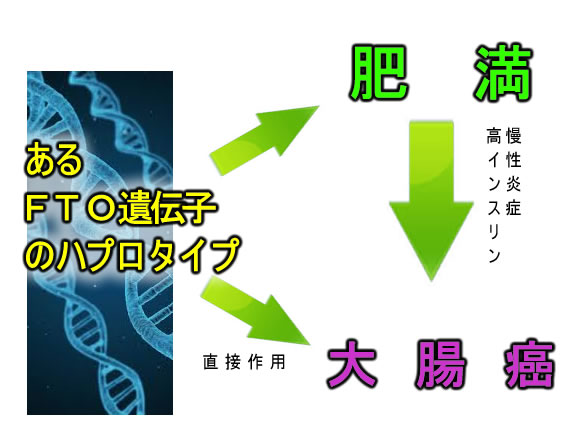
そのようなハプロタイプの方は「太っていなくても癌になり易い」という報告が2013年Natureにありました。元の体質は変わらないからです。FTO仮説では「生まれつき太りやすい体質」の方は、減量しても癌予防には有効ではない。「FTOを阻害する薬剤の方が効果的」という結論になります(実は、そのような薬剤は開発中です。また下記のように自然食品にもあります)
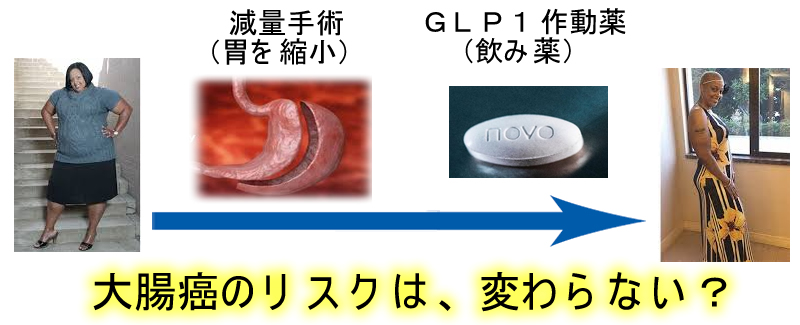
医学の進歩により「劇的な減量」を実現する手段が二つ登場しました。一つは「減量手術」、もう一つは「減量薬」です。
外科的な減量手術(胃の縮小手術)をして体重を減らしても大腸癌の危険は減らない(むしろ増加する)という2019年の報告がありました。その後、反論が出て、現在は論争になっています。
新しいタイプの糖尿病治療薬(GLP-1受容体作動薬)は食欲抑制作用が強く、一部のクリニックでは「痩せ薬」として使われています(重篤な副作用もあるので、希望される方は糖尿病専門の先生にお願いしましょう)。以前は注射薬しかなかったのですが2020年から経口薬も登場しました。この薬はインスリンを増やしIGF/PI3/Akt/mTOR系を活性化します、つまり細胞成長(腫瘍)を促進します。当初、この薬は「ヒトの甲状腺癌を増やす」「マウスの膵臓癌を増やす」という報告があり(2011年Review 2012年Review)、また類縁のグルカゴンが大腸癌を増殖させる(文献)ことから、GLP−1も大腸癌を増やすのではないか?という議論がありました(2014年文献)。
その後「GLP-1がマウスの大腸癌細胞を抑制した」という2011年報告、「GLP-1がヒト大腸癌細胞の増殖に影響しない」という2017年報告がありました。ただし、実際に人に投与した場合の大腸癌への効果は、まだ確認されおらず不明です。
内視鏡的減量手術は大腸癌を減少させるか?
外科的な手術に代わって最近、非常に増えているのが「内視鏡的減量手術」です。バルーンを留置する方法、胃を小さくする方法、十二指腸を狭くする方法、胃内容物を吸引する方法など多くの新しい手技が世界中で開発されています。歴史が短いために、現時点で大腸癌予防効果が確認されたという報告は有りません。現在、減量手術は「BMI 40以上の高度の病的肥満に限定する。(美容目的では施行しない)」というのがルールです(BMI計算式)。もっと適応を柔軟に拡大して(BMI 30から)多くの国民に「内視鏡的減量手術」を提供すべきいう意見もあります。一方「一度の処置で済む夢の治療ではなく合併症などの長期管理が難しい。適応は慎重にすべき」という意見もあります。「簡単に除去して手術前に戻れる」という意味で「最も施行し易い」のが「胃内バルーン留置」です。2021年に、胃内バルーンが脂肪肝(肝臓癌の原因になります)を改善すると結論されましたが、大腸癌予防効果は、まだ確認されていません。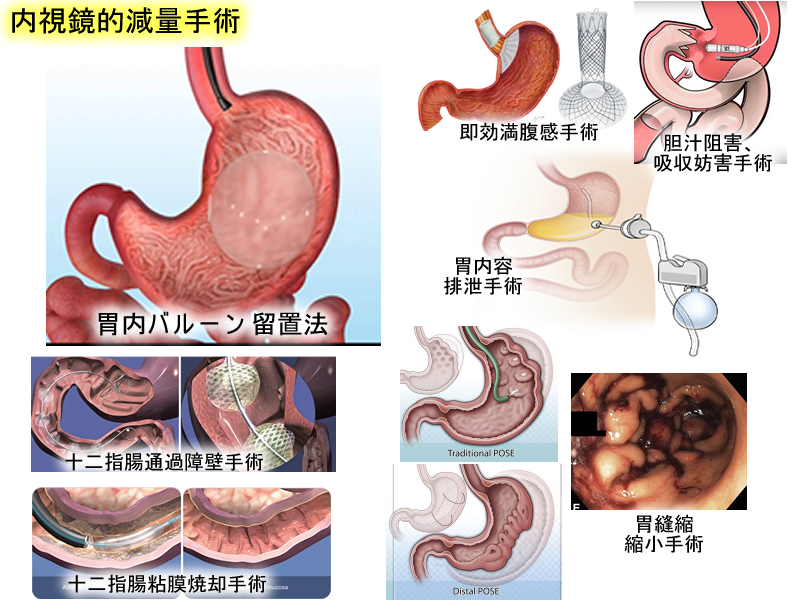
さて・・・
「手術も、薬剤も抵抗がある。でも減量できない」という方には(エビデンスのレベルが、ものすごく低くなるのですが)・・・
(1)緑茶に含まれるカテキン(2)センナ系下剤に含まれるレイン(3)新鮮な野菜・果物(4)ショウガ、はちみつ、ワインになど含まれるポリフェノール類が「FTOの抑制に有効だろう」という説があります(2019年Review 2019年の報告 2020年Review)。

