前回の記事で、グループ1型内分泌癌は通常の腺癌の脱分化で生じる、と書きました。
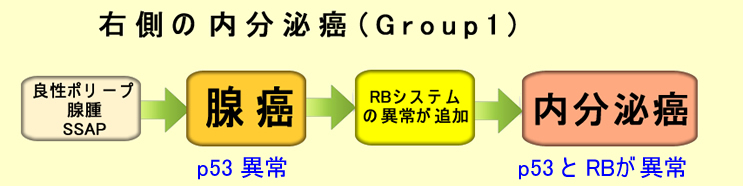
しかし、このような脱分化(化生)は、決して癌に限定した現象ではありません。消化管では、良性(炎症)所見として、日常的に見られます。(例:慢性胃炎に起こる腸上皮化生(胃粘膜が腸化する)やバレット食道(胃粘膜化)、十二指腸に起こる胃粘膜化生など)。
多細胞生物の細胞分化は遺伝子配列の変化で起きるのではありません。「Cell メモリー」で起きます。では「Cell メモリー」は何か?というとエピゲノム的な変化(DNAのメチル化=サイレンシング)で起きます。
ではDNAのメチル化=サイレンシングの進化的意義は何か?
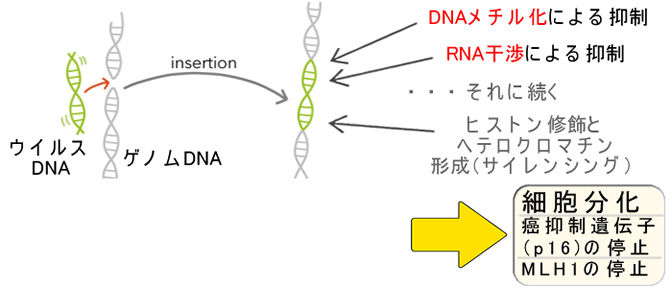
この現象は「潰瘍性大腸炎の原因はトランスポゾンらしい」という記事で書いたものです⇒本来、DNAメチル化(RNA干渉)は進化的にウイルス・トランスポゾンへの防御機構として生まれたと予想されています。これが、やがて自己の遺伝子も抑制するようになり(DNAサイレンシング)、多細胞生物の「細胞分化」を生んだと考えられています(The Cell 6版 7章)。しかし、これが過剰に働いで、p16を停止させて胃癌の原因になり(EBウイルス胃癌)、MLH1(DNA修復酵素)を停止させて「ゲノム不安定型大腸癌(CMS1)の原因(CIMP)」になります。
(専門的)大腸癌のDNAメチル化(CIMP)の原因はJCウイルスか?
(1)過去にHPV、EBウイルス、B型肝炎ウイルスなど、多くの発癌ウイルスと大腸癌との因果関係が調べられたが、最も証拠が多いのがJCポリオーマウイルス(JCV)である。(2020年Review)(2)SV40 , BKV , JCV , LPV, KIV , WUV , MCV(Merkel Cell Py) などの株がある。健康成人に広く蔓延しており(無症状感染)、小児期に食事を介して感染する(1,2)。大腸癌でない健康な腸粘膜からも広くJCV・DNAが検出されるが、大腸癌部分からはウイルスDNAが60倍の量になっている。 (3)癌遺伝子はT抗原(SV40と同じ)。作用機序はHPVのE6,E7に似ているが、一つ大きな違いがある。βカテニン(WNTシステム)に作用するという点である。 (4)大腸癌の60%でT抗原DNAが検出されるという報告があったが、その後「それらのDNAは全く転写されていない」という報告が有り、その後、研究の熱意は大きくトーン・ダウンし、最近は否定的な報告もあります。2020年のReviewでは「ウイルスが大腸癌に関与している証拠は乏しい」と結論しています。 (5)2006年にJCVと大腸癌のCIMPに相関関係があるという報告が有りましたが、その後、注目されませんでした。その後、EBウイルスが全く同じ機序(CIMP)で、胃癌を起こすことが解り(TCGAプロジェクト)、再び注目されてきた分野です。 |
(専門的)DNAメチル化(CIMP)は自己免疫疾患のような現象ウイルスDNAを自らのゲノムに組み込みanti-sense RNAを転写して(RNA干渉)、ウイルスへ対抗するという「核酸免疫」は細菌に見られる最も原始的な適応免疫です(CRSPRシステム)。そして、我々の細胞内にも同じシステムが見つかっており、更にRNAウイルスを逆転写してDNAに変換しゲノムに組み込みます。SARS-Cov-2でも、この現象は確認されています。RNA干渉では同じ配列でも自己のDNAとウイルス由来のDNAを未知の方法で区別していることが確認されています。この「自己・非自己の区別」は生殖細胞の核酸免疫であるpiRNAで研究されていますが、最も謎の多い分野です(The Cell、7章p433)。ウイルスに対抗する核酸免疫が、自己の遺伝子であるp16やMLH1をサイレンスしてしまう現象は、この区別がうまくいっていないことを意味します。つまり「核酸免疫」が自己のDNAを攻撃している(=自己免疫疾患)とも言えます。逆にLINE1の低メチル化は「核酸免疫」における免疫不全とも言えます。 |
良性の大腸ポリープに、JCウイルスなどが感染すれば、分化の異常(化生)が見られても、何ら不思議は無い訳です。化生によりポリープの悪性度が上る場合もあれば、変化しない場合もあります。多くの場合、悪性と紛らわしくなる。悪性度の評価が難しくなる、などの「病理診断上の混乱」を生じます。
この問題を扱った2021年の興味深い文献がありました。著者はオランダの病理学者です。
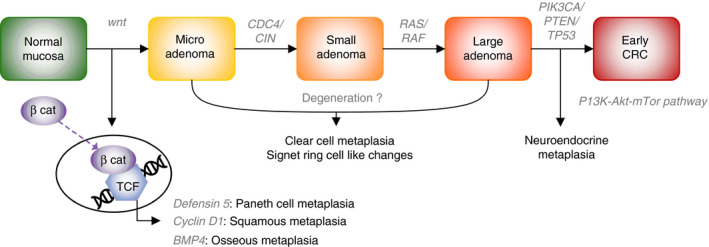
上記文献より
以下、重要度の低い順に列挙します
印鑑細胞様変化
これは、私も経験があります。通常の過形成ポリープ切除した所、病理の先生から「印鑑細胞癌の転移を疑わせる」と報告を受け、大慌てしました。杯細胞(粘液を産生する細胞)の豊富なSSAPで、切除の際の機械的な挫滅で細胞がバラバラになり印鑑細胞様になることがあります。臨床的な意義は何もありません。ただ、誤診で不要な外科手術をすることを回避する、ことだけが重要です。
明細胞化生(Clear Cell Metaplasia)も同じ範疇です。
骨化生
ポリープの内部の間質の繊維芽細胞が骨芽細胞に変わります。その結果、ポリープの一部が骨化します。炎症性ポリープに、見られます。単なる「機械的刺激、炎症の結果に過ぎない」という意見と、「腫瘍細胞がBMP(骨形成因子)を分泌している所見である」という意見がありますが、結論は臨床的な意義は何もありません。
扁平上皮化生
論文著者は「臨床的な意義は何も無い。扁平上皮化生が見られても、特にポリープが悪性度が高いことを意味しない」と延べています。
サイクリンD1の発現が亢進している、という報告が有ります。サイクリン=Rbシステムなので、これはポリープが「内分泌腫瘍の性質を持った」ことを意味します。
また「βカテニン蓄積(WNTシステム異常)が見られる」という報告が有ります。腺腫(既にWNTが異常)では、意味はありませんがSSAPの場合は重要な意味があります。SSAPの場合は「WNT異常=Dysplasia=癌の危険高い」だからです(詳しく)。
内分泌化生(MANET)
進行した大腸癌では、内分泌化生(NeuroEndocrine Cell-Differentiation)は、ありふれた現象であるが、良性ポリープでも3.8%に見られる。この場合はMANETと呼ばれる。MANETは「高度異型腺腫」に、よく起こる傾向があるが、ポリープのサイズや発生場所には傾向は無い。βカテニン蓄積が見られれ、FAPに多いことから「WNTシステム異常の一つの曲面」と考えられる(文献)。p53、KRAS,BRAF,PIK3Cの異常は通常の腺腫と比較しても差は無い。またMSIも無い。これは「グループ1型の内分泌癌が激しい遺伝子異常がある(=大腸癌の遺伝子異常+RBシステム異常+MSIが多い)」とは対照的である。結論としてMANET現象はWNTシステム異常だけで起こる現象であり、臨床的な意義は「高度異型腺腫」と同じであり予後は極めて良好である。MANETをMiNENと同一視すべきではない。
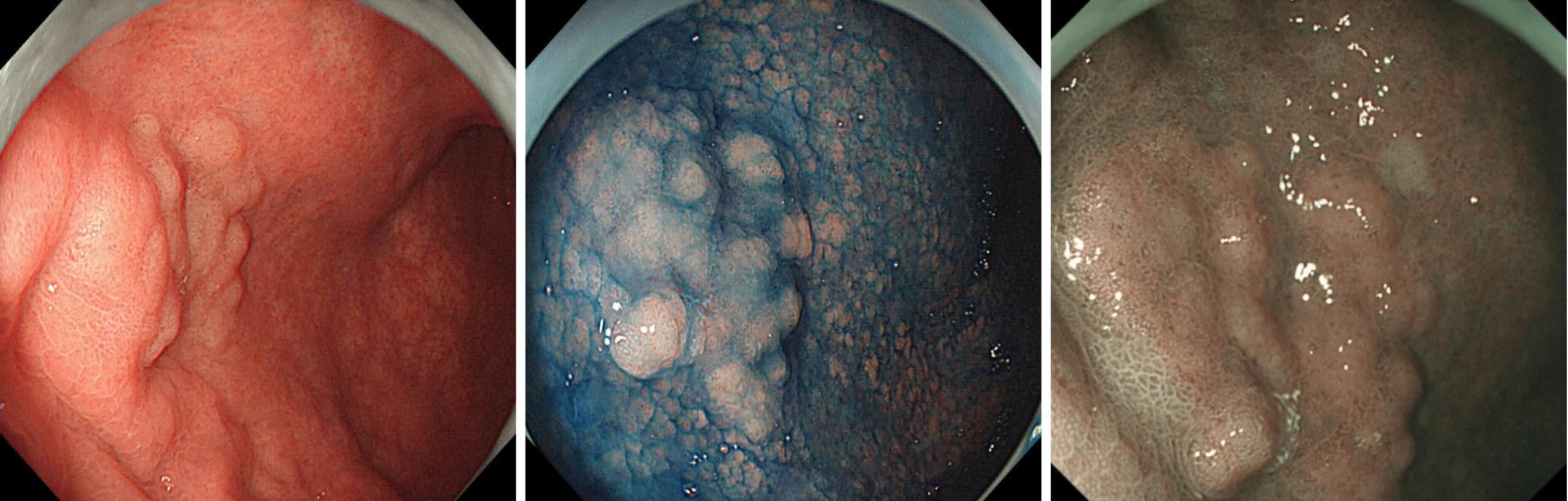
胃のMANET(2020年の報告) 通常の腺腫と同様にESDで根治されています
パネート細胞化生
パネート細胞が幹細胞を作る
パネート細胞は腸の陰窩の深部で幹細胞(=Lgr5細胞)の隣に位置し、隣の細胞を「幹細胞にする」働きをします。女王バチは、ロイヤルゼリーで生まれますが、ロイヤルゼリーを作る細胞と言えます。慶應大学の佐藤博士が発見した日本の誇る研究です(文献)。
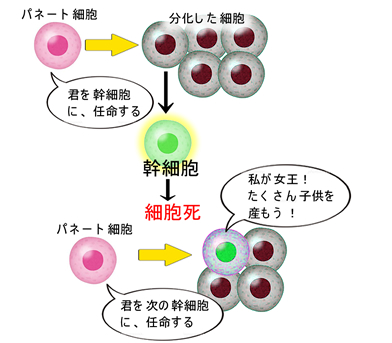
下の図が世界に衝撃を与えた佐藤博士の有名な研究です(The Cellより)
1個の腸の幹細胞(Lgr5細胞)を培養していきます。すると、幹細胞は最初にパネート細胞を作ります。そして、そのパネート細胞の隣が幹細胞になります。ずっと、幹細胞のまま分裂増殖すれば、「未分化癌」なので、これは自然な現象と言えます。「親が子供を作り、その子供が又、親を作る」という関係です。培養された細胞は、陰窩と同じ構造(オルガノイド)を作ります.

