高校数学Ⅲを学ぶと「指数関数と三角関数が同じ関数」と知り感動しますが、医学でも「違う疾患が、実は本質は同じ疾患だった」ことが解明されることがあります。
潰瘍性大腸炎と若年性大腸癌は「若者に多く、生活の欧米化で増加している」など似ているのですが、最近、両者共にトランスポゾン(=太古に我々に感染した内在性ウイルス)が原因らしいという事実が明らかになりました。

若年性大腸癌ではLINE(mRNA型トランスポゾン)が活発に動いている(低メチル化)という報告が複数ありました(1,2,3,Review)。
一方、HERV(レトロウイルス型トランスポゾン)の活性化が上皮細胞の死となり潰瘍性大腸炎を起こすと2020年Natureに報告されました。
若年性大腸癌も潰瘍性大腸炎も、言わば「トランスポゾン(内在性ウイルス)病」だった訳です。
| 今回は基礎医学の話(専門家向け)になります。尚、「潰瘍性大腸炎や若年性大腸癌は感染性疾患か?」という不安は無用です。何故なら「人は皆このウイルスに何百万回と感染している」からです。 |
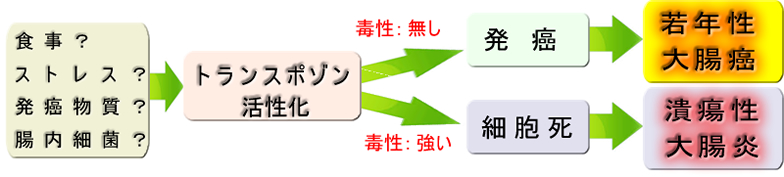
両者は、どこが違うか?
「トランスポゾン移動の程度・毒性」なのでしょう。移動が少量で毒性が弱く「変異原性」で済むと発癌に至る。しかし移動の量が甚だしく毒性が強いと細胞は死んでしまい大腸炎になるのでしょう。
なぜLINEは若者に癌を作るのか?
大腸癌でLINEが動いているという最初の報告は2012年にあり、必ずしも「若年性癌に特異的」ではありません。LINEの活性化が個体発生で制御されているのと関係があるのかもしれません。トランスポゾンの移動が同時多発的に進行すると短期間で癌化に至る(ゲノム不安定性)ため「若者でも癌化する」ということなのかもしれません。
なぜトランスポゾンは大腸で、よく動くのか?
SLEなど他の自己免疫疾患に広くトランスポゾンが関与してるという報告(2020年Review)があり、決して「大腸だけ」の現象ではありません。しかし、下記にあるように消化管は(脳の次に)LINEが活発に動く臓器です。
潰瘍性大腸炎は単なる大腸のアトピーではない。HNPCC状態(ゲノム不安定)である訳です。
このような認識がこれからのスタンダードになるでしょう。潰瘍性大腸炎は大腸癌が合併するリスクが高く、癌の特徴(未分化、高悪性度)がEOCRCと類似していますが、トランスポゾン病と考えれば説明がつく訳です。
未解決の課題(1)「何故トランスポゾンが目覚めるのか?」
一般にトランスポゾンを抑制する機序は「DNAメチル化、ヒストン修飾とヘテロクロマチン化、RNA干渉」です。これらの現象の鍵となる重要な分子は、HERVではTrim28、SETdb1,KRAB-Zipなどです(2020年,)。Natureの報告では「SETdb1機能障害⇒HERV活性化」という機序が報告されているが、では何故SETdb1の機能障害が起こるのか?は未解明です。
一方LINEの「移動抑制装置」はSub39a,HUSH,SLFN14,Rhox などが報告されていますが、この中でEOCRCや癌で機能低下が確認されたものは無いです。またEOCRCで見つかっているARID異常とLINEを繋ぐ報告も今の所、無いです。
未解決の課題(2)「低メチル化なら動いていると言えるのか?」
多くの報告はトランスポゾンの低メチル化を調べているだけで、実際にトランスポゾンが「動いている」ことを確認していません。しかしLINEは「生殖細胞ではpi-RNAにより抑制されるが、受精後はメチル化により抑制される」。従って「低メチル化=動いている」と見なすのが定説のようです(2021年Review)。特に胚では、この現象がゲノム全体に起きます(文献)。
未解決の課題(3)「潰瘍性大腸炎では、なぜ大腸粘膜が広範囲に死ぬのか?」
SLEなど他の自己免疫疾患にも広くHERV(レトロウイルス型トランスポゾン)が関与していますが潰瘍性大腸炎ほど組織が広範囲に壊死する病態はありません。腸の細胞は寿命が3日で人体で最も回転が早いです。新生も早ければ死ぬのも早い訳です。「腸の炎症と細胞死(Necroptosis)」は最近、重視されている分野で(2020年 2020年 2018年)、ZBP1、RIP、MLKLなどの主要分子が注目されています(2020年)。注目すべき点はDouble-strand RNAが最初の刺激になる点です。ds-RNAはTLRなどの対ウイルス自然免疫センサーが感知する代表的PAMP(病原体パターン分子)であり、自然免疫システムの一つであることが示唆されます。
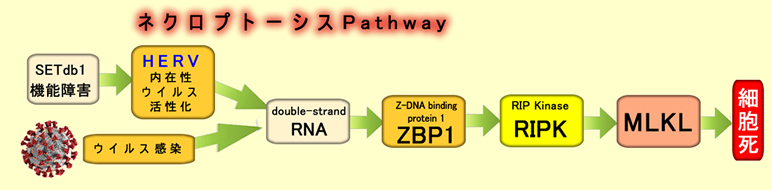
未解決の課題(4)「潰瘍性大腸炎への抗・壊死療法は是か?」
トランスポゾンが原因なら、炎症を起こした細胞が死ぬのは「癌化を防止するため」とも解釈できます。上記のNature報告では「RIPを抑制してNecroptosisを抑え潰瘍性大腸炎を治す」という強引なアプローチを提案しています。RIP阻害剤は臨床応用が期待されています(2020年)。しかし、「抗・壊死療法や強力な抗炎症療法・免疫抑制療法は若年性大腸癌を促進する危険が無いのか?」を再検討する必要があると思います。
| 大腸癌に見られる「ゲノムの広範囲メチル化(CIMP)」はウイルスへの防御機構である |
腸上皮化生、バレット食道、そしてSSAP(腸の胃化)など、消化管の癌は分化の異常と深い関係があり、広範囲のゲノムのメチル化(CIMP)を伴います。これらの現象の本質的な意義は進化的にウイルス・トランスポゾンへの防御機構と考えられています。これが、やがて自己の遺伝子も抑制するようになり(DNAサイレンシング)、多細胞生物の「細胞分化」を生んだと考えられています(The
Cell 6版 7章)。ウイルスとCIMPの関係の報告は多く、JCウイルスと大腸癌のCIMPの関係、EBウイルスと胃癌のCIMPの関係、肝炎ウイルスとHCC、などで報告が有ります。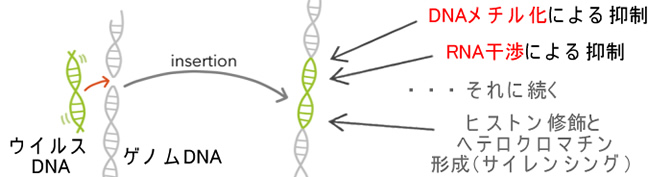 CIMPの場合は、ウイルスへの防御(サイレンシング)が、強すぎて、自己の癌抑制遺伝子をもサイレンスしてしまうと、いうモデルでした。 しかし、若年性大腸癌の場合は、逆で防御(サイレンシング)が、弱すぎて、内在性ウイルスが活動し発癌するというモデルです。 同じ様に見えますが、本質は180度、逆の現象と言えます。 |
| トランスポゾンの生物学 |
| 2018年NEJM誌はトランスポゾンの特集を掲載しました。臨床医学が、いよいよ多細胞生物の本質(クロマチン、DNAサイレンシング)に迫る時代が来た訳です! トランスポゾンの基本2018年NEJM誌記事の要約 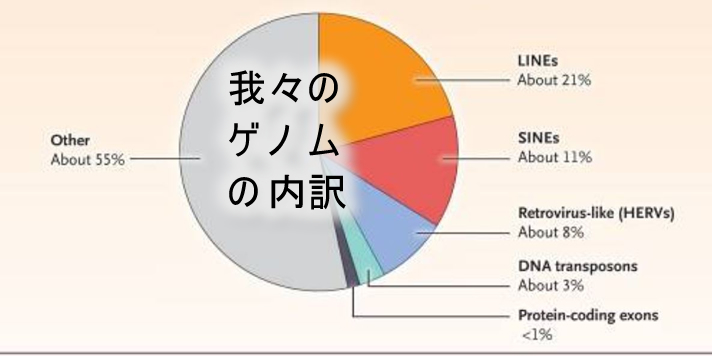 HERV=レトロウイルス型。LTRを持つ。LINE,SINE=mRNA型。LTRは無くpolyAを持つ。HERV,LINE,SINE共に現在も移動している(active)が、前2者が「自立している(自分のReverse Transcriptaseを持つ)」がSINEは自立して無く(自分のRT無し)、複製にはLINEのRTを「借りる」。最も活動が盛んなのはLINEで「人のDNA変異のの250分の1はLINEが原因」という説がある。有名なAlu配列はSINEの一つ。 DNA型トランスポゾン 人では不活化していて原則として動かないが、進化で重要な働きをした。適応免疫の獲得(RAG=recombination-activating genes)、胎盤の獲得に貢献したらしい。 レトロウイルス型トランスポゾン(HERV) 自然免疫系遺伝子(IFN関連)の近傍にあり過去のウイルス感染時にセットで組み込まれたらしい(2016年)。今もウイルス感染を引き金にしてHERVはIFN関連遺伝子と共に転写される。まるで細菌のCRISPRシステムのように「ウイルス由来遺伝子が対ウイルス防御」に働いている(旧いウイルス感染が新しいウイルス感染を防ぐ干渉現象)(2018年)。 HERVを抑制するシステムの不調が「HERVの過剰転写⇒自然免疫系を賦活⇒自己免疫」を起こすらしい(重要なのはTrim28、SETdb1,KRAB-Zip2020年,)。 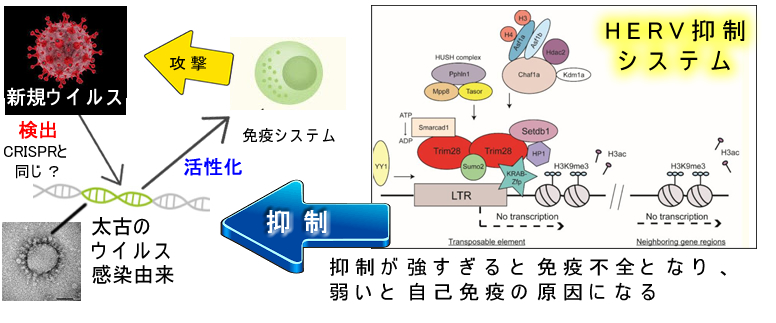 mRNA型トランスポゾン(LINE,SINE) HERVが免疫系に作用して機能的な異常を起こすのに対して、mRNA型の方は(圧倒的に動く頻度も存在頻度も高く)、機能とは関係無く、挿入に伴い物理的にゲノムを破壊することで多様な疾患の原因になる。LINEは挿入変異が多く、Aluは「Alu-Alu組み換え変異(例)」の誘発が多い。減数分裂200回につき1回の頻度でLINEは動き、これが個人・民族の多用性になっている(例:日本人に多い福山型ジストロフィー)。生殖細胞だけでなく、受精後も発生段階(特に脳)でも動いている。統合失調症との関係の報告もある。 成体で脳の次にLINEが良く動くのは消化管である。そのため「LINEは特に消化管癌と関連」がよく研究されている(2021年、2015年)。一方、多彩な挿入が起こることから「病因では無くて結果。Driverではなく、ゲノム不安定によって起きたPassenger」という面もある |
| トランスポゾンの、興味深い話題を幾つか・・・・・・ |
| microRNA128 私見ですが上記のごとくRIP Kinase阻害剤のような「抗・壊死療法」は発癌のリスクがあり本命にはならないと予想します。内在性ウイルスを抑制する生体本来のシステムは「RNA干渉」です。生殖細胞では「piRNA」が、主役ですが、piRNAが発現していない成体ではmicroRNA128が、似た方法でLINEを抑制しているらしいです(2016年)。以前なら「夢物語」扱いされる話ですが、Ψ-RNAワクチンが驚くべき速さで投入されたことを考えると、miRNA128入りのリポフェクチンの臨床応用も、そう遠くないかもしれない。 piRNAについて The Cell 第7章 p433より「piRNAについては謎が多い。多くの哺乳類のゲノムには 100万種類以上の piRNAの暗号が含まれており,精巣で発現されるが,ゲノム内に存在するトランスポゾンの抑制に向かうのはごく一部のようである。では, piRNAは過去の侵入者の名残なのだろうか。 piRNAがこれほど多くの “塩基配列スペース”を取っているのは,あらゆる外来 DNAを広く防御するためだろうか。 piRNAのもう 1つの興味深い特徴は,その多くは原理上,個体が作る正常な mRNAを攻撃してしまうはず(特に塩基対形成が必ずしも完全でないとすれば)だが,そうしないことである。これらの膨大な数の piRNAは, “自己 ” RNAと “外来 ” RNAを識別するしくみを作っているのではないかという説もある。それが正しいなら,細胞が自身の RNAを許容する特別な方法があるに違いない。 1つの説では,ある個体の前の世代で作られた RNAは何らかのしくみで登録され,それらが以後の世代で piRNAの攻撃を受けないようにしているとされる。このしくみが果たして実在するのか,また,もし実在するならどのように働いているのだろうか。そんな疑問がわいてくるのも, RNA干渉の意義が完全に解明されていないからこそである。」 |
| ゲノム不安定とは「ゲノム可塑性」でもある なぜ人の知能は猿よりも驚異的に高いのか?これは脳の大きさ(ニューロンの数)では説明できません。有力な仮説は,人の脳の細胞は抗体を作るB細胞のように「多様な細胞の集まり(モザイク)」だから、という説です。例えば「プロトカドヘリン」は免疫グロブリンのように多様性があり脳のモザイク化の機序の一つと考えられています。そしてLINEも脳のモザイク化の機序の一つと考えられています。つまり「不安定性」とは「可塑性」だった訳です(2017年Review) |
| 胚でもLINEが動く 生殖細胞ではゲノムは高度にメチル化されて「遺伝子が凍結状態」にあります。受精卵では広範囲なゲノムの脱メチル化が起きます。この時に、LINEが動き、何か所かの挿入変異を起こします。これは「変異」とも言えるし「ゲノムの可塑性(進化の原動力)」とも言えます。この時期は短く、胚が数回、細胞分裂数すると成体と同じレベルにメチル化されます(2020年Review)。 |
| iPSではLINEが永遠に動いている iPSの場合は胚細胞の状態(低メチル化ゲノム)で培養・増殖されるのでLINEの影響(変異原性)が大きくなる危惧がある。この問題は2012年に指摘され、2014年には「動いていない」と否定的な報告があったが、2016年にNatureに「やはり動いている」という報告が有り。更に「LINEが動くことが万能性の維持に不可欠」という説まで出てきた(2020年Review)ので、かなり「iPSの再生医療応用に暗雲が立ち込めてきた」感がある。この課題はiPSでなくES細胞を使っても解決しない。「胚を培養して増やす」という過程は「神の意思に反する」行為だったということか・・・・ |
| LINEも「RNA修飾」を利用している コロナなウイルスのΨ-RNAワクチンの「シュード・ウリジン」が注目されているが、LINEは「メチル化アデニン」でホストの翻訳システムを「乗っとる」らしい。つまり病原性を持つウイルス感染と同じように「ハイジャッカー」になるらしい(文献) |
| 現在もRNAウイルスは逆転写されて我々のゲノムに組み込まれている 進化の過程で起きた現象だから今も起きていても驚くことでは無いが、最近ではコロナウイルス(Cov2)でも確認され話題になった。しかし宿主ゲノムへのウイルス遺伝子の取り込み現象(transcript reversion)はトランスポゾンの専門家には「常識の話」になっているようだ(大阪大学HP)。やはりLINEの逆転写酵素を「借用」するらしい。 |
| 我々のmRNAは逆転写されないのか? cDNAライブラリーを作製した経験のある方なら「容易に起こる現象のはずだ」と思うはず。我々のゲノムには多くの「遺伝子ファミリー・偽遺伝子」がある。このうち「プロセス型・偽遺伝子」はイントロンを持たないことからDNA⇒mRNA⇒DNA⇒ゲノム組み込み、という経過で生まれたと考えられている。やはりLINEの逆転写酵素を「借用」すると思われる。するとLINEのRNAやウイルスのRNAよりも「遥かに大量のmRNA」がゲノムの脅威になるように思うのだが、細胞には「mRNAの逆転写を防止する特別な装置」があるのだろうか?今後「RNAを薬として投与する時代」が来るが、人工的なRNAも制御されるのだろうか?RNA⇒cDNAは増幅されるのでDNAを投与する場合より危険かも? |
