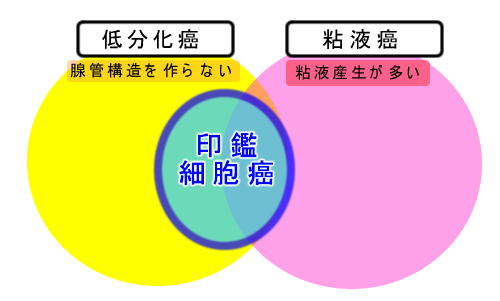
大腸癌の中で悪性度の高い代表的な癌は「粘液癌・低分化癌・印鑑細胞癌」です。悪名高いスキルス胃癌が胃の「印鑑細胞癌」です。これらの高悪性度大腸癌の関係は下図のようになります。
(最近「低分化癌」という用語は「High Grade癌」に変わりました(2019年WHO分類)が必ずしも「低分化=高悪性度」ではないので、ここでは「低分化癌」に統一します)
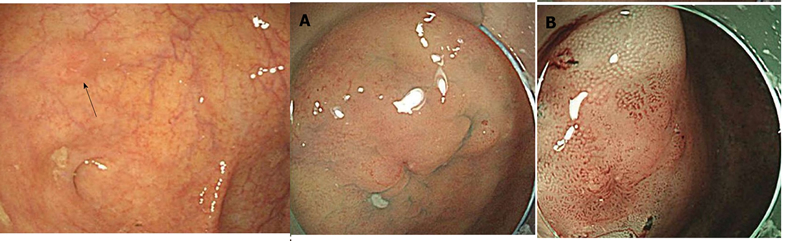
高悪性度癌は、その多くが進行癌で見つかります。下記の写真は極めて珍しい「初期の低分化粘液癌」の報告です。
 |
|
| 韓国からの報告(初期の印鑑細胞癌) | 秋田赤十字病院からの報告 (初期の低分化癌) |
遺伝子解析から、これらの癌の起源は「腺腫ではなく過形成ポリープらしい」というのが、今回の話なのですが、形態からは予想された話です。高悪性度癌も過形成ポリープ(SSL)も境界が不明瞭で、正常粘膜に近く炎症のように見えるのが特徴です。
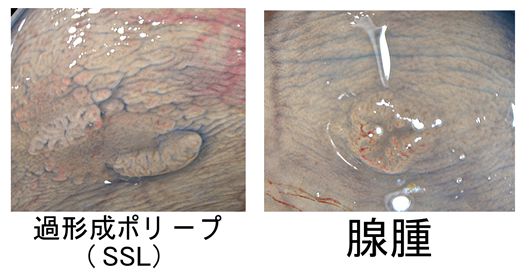
| (重要な事実)高悪性度癌の一部は腺腫・腺癌が起源 |
これは内分泌癌のグループ1と同じ機序です。腺腫から印鑑細胞癌が発生した例が報告されており(1、2、3、4、5)、「腺腫⇒印鑑細胞癌」のルートは確実に存在します(2016年文献)。また通常の腺癌の一部に印鑑細胞癌が混在することもあります(2019年文献)。通常の腺癌に遺伝子異常が追加され印鑑細胞癌になる訳です。このタイプへの内視鏡検診での対策は通常の大腸癌と同じ(腺腫を検出し除去する)ですので検診の上では特別な問題は、ありません。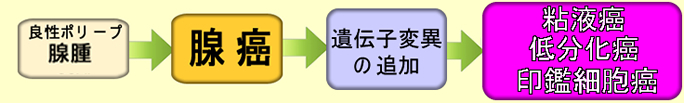 これとは異なり、腺腫・腺癌が併存せずに印鑑細胞癌が、いきなり発生する場合があります(上図;症例報告)。起源が謎で内視鏡検診で特別な対策が必要なのは、このような「非・腺腫型」であり、この起源が実は過形成ポリープである、というのが今回の話です。この二つのタイプは全く異なる癌であり、厳密に区別しなければいけません。内分泌癌もそうなのですが、この区別が曖昧であったために長年の混乱が生じました。 |
癌の起源(良性ポリープ)を解明する現代の手段は遺伝子解析です。「癌XとポリープYに同じ遺伝子異常が見つかれば、癌XはポリープY由来である」と推測されます。
大腸ポリープが癌化する経路は以下の3つが基本形です。
| 前癌病変(ポリープ) | 遺伝子変化 | MSI (マイクロサテライト不安定性) |
| 腺腫 | APC,KRAS,p53、CIN(染色体不安定性) | 無し |
| 右の過形成ポリープ (Serrated Pathway) |
BRAF,CIMP | 有り |
| 左の過形成ポリープ (TSA Pathway) |
KRAS,MGMT(塩基置換不安定性) | 無し |
(詳細は以下の専門的な話になりますが、要点は)、高悪性度癌の遺伝子異常は・・・
(1)腺腫型(APC、KRAS,p53)は、極一部で少ない
(2)半分はSerrated Pathway型でMSI(マイクロサテライト不安定性)が陽性
(3)半分はTSA Pathway型ではないか?と思われるのだが、特徴的な遺伝子異常が少ないので証拠が不十分。MSIは陰性である。
粘液癌は過形成ポリープから、過形成ポリープは杯細胞から発生する。
腸の粘液バリアーと腸管免疫の関係が重視され、杯細胞(=粘液分泌細胞)の研究が盛んです。潰瘍性大腸炎では「杯細胞の減少⇒粘液の減少⇒腸管免疫の異常」という仮説モデルがあります。
一方、過形成ポリープ・SSAP(鋸歯状病変=粘液産生が多い)、印鑑細胞癌などの粘液癌は「杯細胞が腫瘍化した」という仮説モデルがあります(2006年の文献)。
| (専門的)追加資料 | 粘液の分子生物学 |
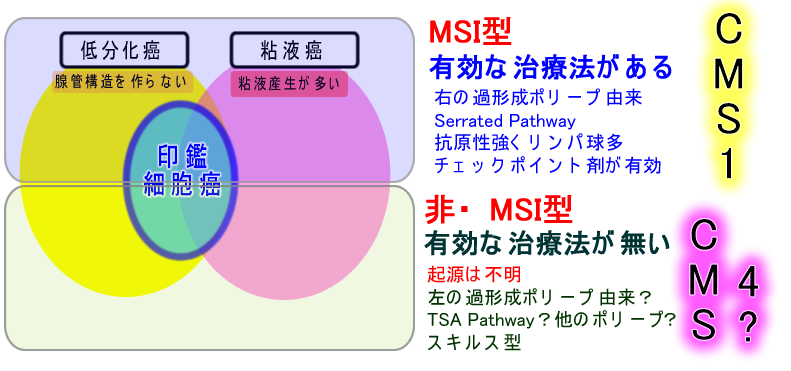
高悪性度癌ではMSI(マイクロサテライト不安定性)の有無が重要!
理由はMSI陽性ならオブジーボなどの免疫チェックポイント阻害剤が著効するからです。「MSI陽性⇒遺伝子変異多い⇒抗原性強い⇒免疫反応強い」からで「腫瘍浸潤リンパ球が多い」からです。今まで予後不良とされていた高悪性度癌に、著効する治療が見つかったという話であり、最近、数年間の大腸癌治療の最大のトピックスです。2012年、米国のTCGAプロジェクトで、初めてHypermutated(高頻度に遺伝子変異がある)タイプが同定されましたが、これが「MSI陽性タイプ」です。
リンパ球浸潤の多い大腸癌は予後が良いか?
一般に「リンパ球浸潤が多い⇒抗原性が強い⇒免疫療法が効果的」を意味します。該当するのは(1)MSI陽性癌(2)リンパ上皮癌(EBウイルスなどが関与)(3)GALT癌(2019年Review)(4)CMS4型癌です。この内、(1)〜(3)は、確かに免疫療法が効果的です。しかし(4)CMS4型癌は、免疫療法は無効で予後が悪く「浸潤しているリンパ球(Th17,Treg)は、むしろ癌を促進している」ように見えます(⇒大腸癌免疫のパラドックス)。
(専門的)低分化(HighGrade)癌の遺伝子解析低分化癌はMSI(マイクロサテライト不安定性)の割合が高いことが報告されました。しかし、MSI癌は予後が良いというのが通説であり「矛盾した現象」と思われました。この矛盾は2007年の東大の報告で解決しました(文献)。低分化癌を予後の良いMSI型(2割)と予後の悪い非MSI 型の二つに分類できるという報告です。同様の報告は2021年にも出ており二つの群での遺伝子異常の違いが詳細に報告されています。p53,KRAS,遺伝子重複がMSS型の特徴と報告されています。 そして更に「MSI型低分化癌」の中には非常に予後の良い特殊な低分化癌があることも解りました。髄様癌と呼ばれる特殊な大腸癌です。高 齢女性の右側の低分化 癌 は、ほとんどが髄様癌です(文献)。 予後の良い低分化癌という不思議な癌 何故、髄様癌は低分化なのに予後が良いのか?理由は「遺伝子変異多い⇒抗原性強い⇒免疫反応強い」からで「腫瘍浸潤リンパ球が多い」からと推測されています。(当然、免疫チェックポイント剤が著効すると予想されます)。髄様癌と酷似する癌に「リンパ上皮癌」という癌があり、こちらはEBウイルスなどが原因で、やはり腫瘍浸潤リンパ球が多く予後が良好です。髄様癌と「リンパ上皮癌」の関連に注目する文献もあります。ここには癌治療の重要なヒントがあると研究者は注目している訳です。 |
(専門的)粘液癌の遺伝子解析2021年Reviewより。粘液癌は病理学的には2つに分かれます。高分化型(LowGrade)と低分化型(HigeGrade)です。遺伝子変化はSerrated Pathway型(右)とTSA
Pathway型(左)の二つが有ります。いずれも由来は過形成ポリープですが、分化度と遺伝子変化の組み合わせは2X2=4通りあることになります。TSA型はSerrated型より悪性度が高いのですが、「分化度」は悪性度を予測する上で重要ではありません。
分化度以上に「MSIか否か」が重要 長い間、癌の悪性度を決める最も重要な因子は「分化度」と信じられてきました。しかし、粘液癌では、この鉄則が初めて破られました。2010年のWHO指針では「大腸・粘液癌のグレードは分化度(管腔形成度)ではなくて、MSI or MSS(言い換えるならSerrated Pathway型(右)か?TSA Pathway型(左)か?)で決めるべきである」となったのです。その後、一部修正されましたが、これは画期的な出来事です。この指針が出た理由は、上記(低分化癌)と同じで「抗原性⇒腫瘍浸潤リンパ球」が癌の悪性度を決める最も重要な要因、という考えからです( 2020年Nature)。 このような「粘液癌の特殊性」が注目され、臓器の違いを超えた(大腸、肺、乳、胃などで共通する)「粘液癌の特異性」を同定しようという研究もあります(2021年文献)。 |
(専門的) 印鑑細胞癌の遺伝子解析下図は最新の2021年の大腸印鑑細胞癌のReviewからの引用ですが、この図からは本質が解り難いです。 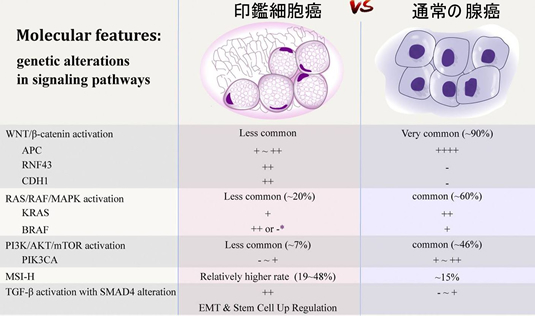 実は印鑑細胞癌も「二つに分ける」と解り易くなります。 2017年、BJC誌に「印鑑細胞癌の半数(右側の癌)はSerrated Pathway型(右の過形成ポリープ由来=CMS1型)であり、半分(左側の癌;特に直腸)はCMS4型」と報告されました。2021年の日本からの報告も同様でした。CMS1は免疫チェックポイント剤が有効です。今まで予後不良とされていた印鑑細胞癌の半分に有効な治療法が見つかった訳ですから画期的な話です。一方CMS4は、そのものズバリ「スキルス型(硬い癌)」ですが、有効な対策は見つかっていません。 では・・・CMS4の起源は何か?これは、現在、最も議論になり、見解が分かれる課題です(⇒過形成ポリープ・SSAPの二つの顔)。
|