マイクロサテライト不安定性(MSI)とは?
ゲノム不安定の場合に見られる現象です。但し決して「イコール」ではありません。「MSI陰性のゲノム不安定」も多いからです(点変異型、染色体不安定型、トランスポゾン型など)。通常、MSI以外のゲノム不安定性は「ゲノムの全解読」をしないと調べられません。ですから臨床の場で使えません。対してMSIはPCRで簡単に調べられますから、臨床の現場ではMSI検査が重宝されます(それだけのことで、これが最も重要という意味ではありません)。MSIはMLH1という遺伝子の機能不全で起きます。MLH1はDNAの校正装置です。HNPCC(リンチ症候群)の方は、体質的にMLH1に異常があり、MSI(+)腺腫が発生します。HNPCCでない方でもSSAP(過形成ポリープ)はMLH1に異常を起こします(以前の記事)。
| (専門的)MSI(+)腺腫の遺伝子解析が進む |
| 「BRAF正常、RAS異常の腺腫がMLH1メチル化からMSI(+)癌に進展する」というモデルが2016年から2017年にかけ報告されました。更に「RAFもRASも正常で、 NTRKKinase-Fusion(+)からMSIになる」というタイプが2019年、2019年、2020年、2020年に報告されます。NTRK Kinase-Fusion(+)は、これを阻害する分子標的薬(日本でも承認)が著効することから「MSI陽性大腸癌はKinase-Fusionの有無を、スクリーニング的に調べるべきである」というコンセンサスが出来つつあります(2019年Nature, 2021年)。つまりMSI(+)腺腫は、癌化率が高いポリープなのですが、その癌の一部は予後良好(薬剤が著効)な癌なのです。 |
| (専門的)MSI(+)癌は「高悪性癌(低分化癌)」とイコールか? |
「悪性度の高い癌とは低分化癌」というのが、(遺伝子解析が進む前の)癌病理学の常識でした。このタイプは腫瘍内に異なる細胞が混在することが多く(Intra
Tumor Heterogenity)、ゲノム不安定性が示唆されることから「MSI(+)癌とイコールではないか?」と予想されています。
この予想を調べた報告は多く、高悪性度癌の「72%がMSI(+)」、「78%がMSI(+)」、「53%がMSI(+)」と報告されています。
非常に矛盾した興味深い話ですが・・
最も悪性度の高い癌=MSI(+)の癌の中に、最も、抗癌剤が効くタイプ(NTRK Kinase-Fusion(+)なので分子標的薬が有効)があるのです!遠隔転移が有っても著効することが2018年NEJM誌に報告されていますが、これは偶然、良い分子標的薬が見つかったからです。 |
| (専門的)ゲノムの不安定性は複数のタイプがある。全てを調べる方法は? |
MSIはサテライトDNAのコピー数の変化という現象ですが、本質は「不対合修復系の異常」であり、ゲノムの「塩基置換」が主な変異です。左側過形成ポリープ(TSA Pathway)に見られるMGMT異常も同じく「塩基置換」になりますがMSIは見られません。
遺伝性乳癌やFCCTX(遺伝性大腸癌)ではBRCAが異常で「染色体不安定性」になります。p53異常も同様でCMS4型はこのタイプです。
若年性大腸癌(EOCRC)ではARID1異常が見られ、「クロマチン(エピゲノム)不安定性」が起きます。
これらの異なる不安定性は、当初は「共存は稀」と考えられました。(The Cell 6版20章p1125)
しかし悪性度の高い未分化癌を調べると複数の不安定性を併せ持つ現象も報告されています。
ゲノムの安定生に関わる遺伝子(Genome Maintenance Gene)は、人では数千個あると予想されており、その一部しか解明されていません。結局のところ、MSI検査は臨床で容易なので重宝されていますが、ゲノム不安定性という現象の、極一部(不対合修復系)しか見ていない訳です。 |
| 現時点では内視鏡でポリープの表面を観察して腫瘍進化(Intra Tumor Heterogenity)の有無を判定することが「最も正確なゲノム不安定性の判定方法」と考えています。これには高解像度内視鏡と色素散布が最も重要と考えます |

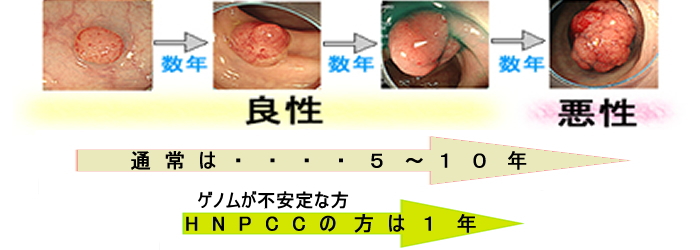
腫瘍進化・ゲノム不安定性
大腸癌の発生には5つのシステム異常が必要です(WNT系、TGFβ系、Ras/Raf系、PI3K/mTOR系、p53系 詳しく)。1つの異常が起こると、新たな細胞株(サブ・クローン)が出現します。そして異常が5回、蓄積すると「完璧な癌」となり転移することが実験的に証明されています。
この過程はダーウインの理論(突然変異と自然選択)による生物の進化と本質的に同じです。
多くの場合、最初の異常は幹細胞化(WNT系の異常)です。これは大腸細胞の寿命は3日しかなく、遺伝子異常が蓄積されるためには、まず「細胞の寿命の延長」が不可欠だからです。
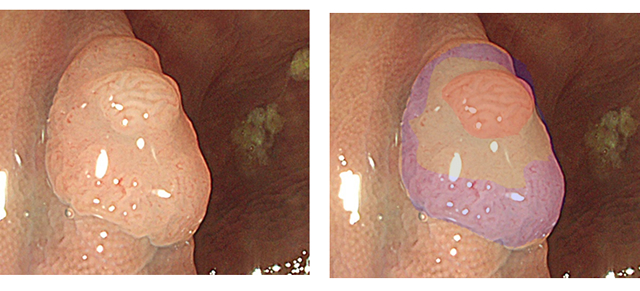
下のポリープは「小さいのに3つのサブクローン」があります。これは、短期間に遺伝子変異が3回起きた(=ゲノムが不安定)ことを意味します。すると、短期間のうちに、更に2つの遺伝子異常が蓄積される(=転移を起こす!)ことが予想されます。
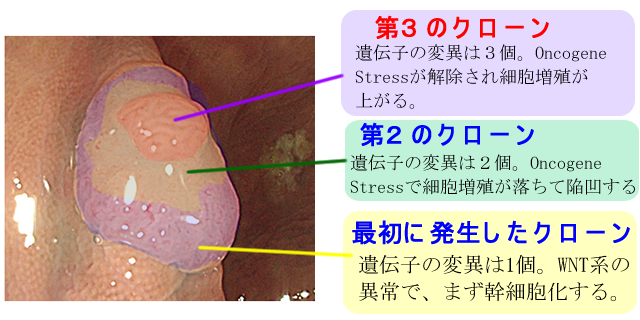
このストーリーは最もシンプルな場合です。実際は、もっと複雑で、エピゲノム異常があったり、長い休眠期間(細胞老化 詳しく)があります。また3つのクローンが全て癌に進化し「サブクローンの混在した癌」になることもあります(Big Banモデル)。
「凸凹(不整)、陥凹しているポリープが危険」であることを、かなり昔から医師は経験的に知っていましたが、その機序(=腫瘍進化)の分子生物学的な解明は、始まったばかりです(⇒2018年文献 2021年文献)。
病理と内視鏡所見の食い違う症例
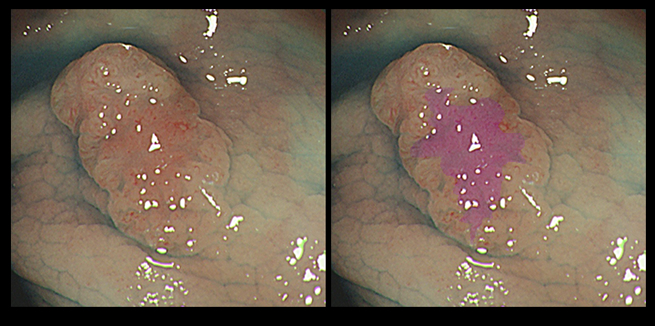
下の写真は内視鏡医なら、表面に「不整」があることから「High Risk腺腫」と診断しますが、病理は「Low Risk腺腫」でした。このような食い違いは、時に経験されますが、分子生物学的に考察するなら以下のようになります。
内視鏡医が昔から観ていた「不整」とは腫瘍進化(Intra Tumor Heterogenity)=「ゲノムの不安定性」であり、病理医の観ていた「異型度」というのは細胞核の形態異常=細胞分裂時のM期check pointの異常による染色体異常(CIN)に相当します。大腸癌の8割は染色体異常(CIN)を伴うのですが、必ずしも病理学的異型度は遺伝子変異の悪性度とは完全に対応しません。下のような病変は染色体異常が軽いため、「核の異型度」が軽いと思われます。
詰まる所、ポリープの危険性を正確に評価することは(全ゲノム解読以外では)、難しい訳です。(個人的には内視鏡所見が病理診断より優先されると考えますが。)