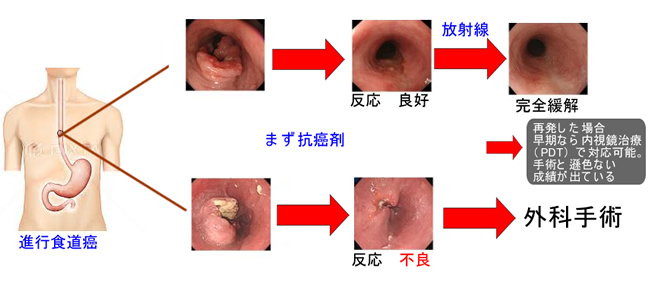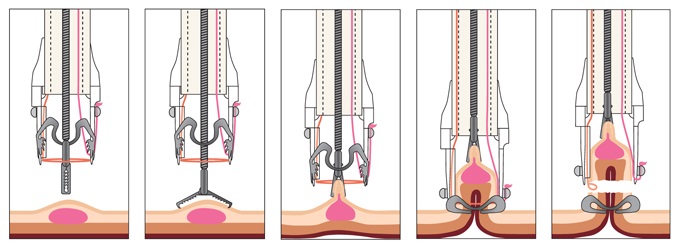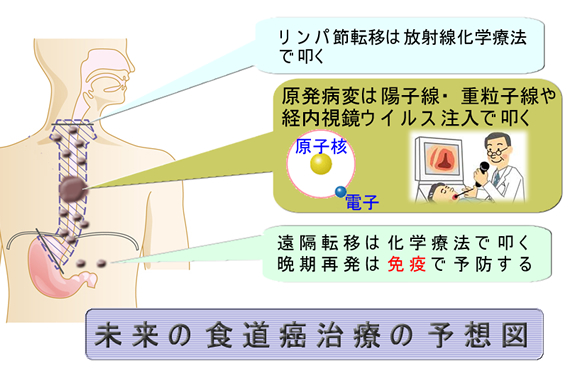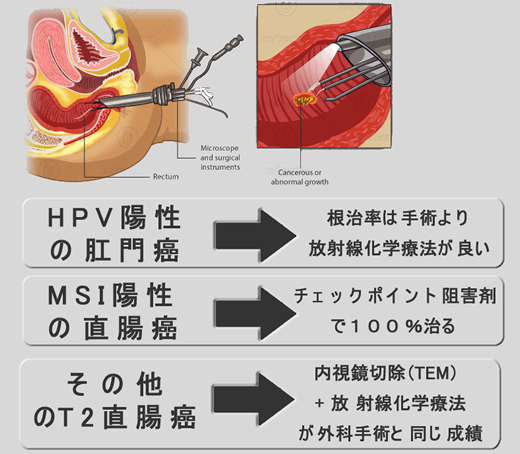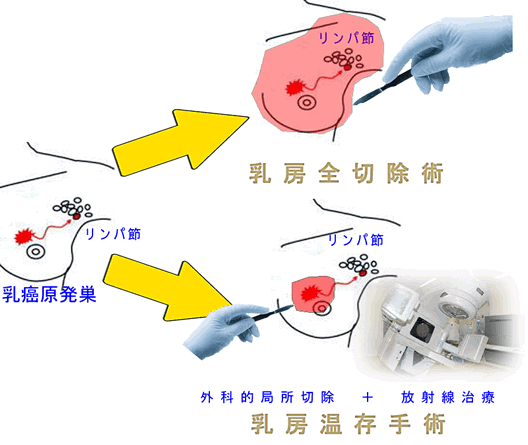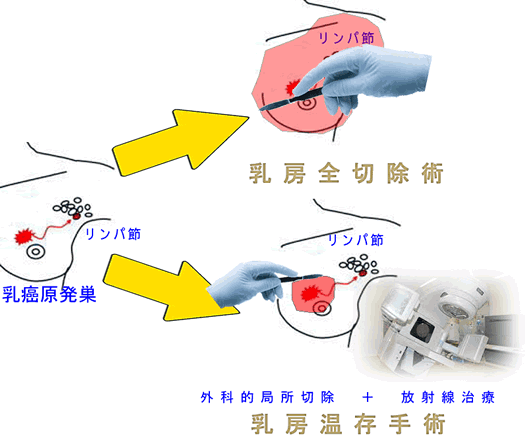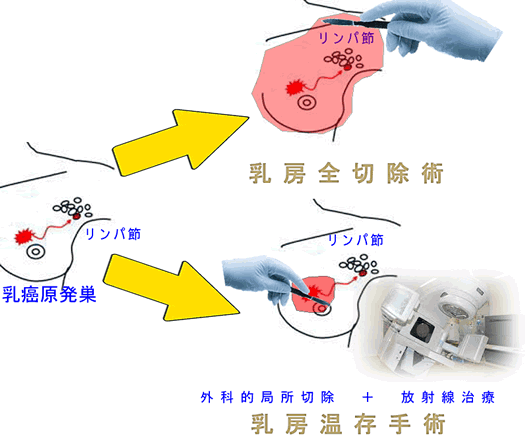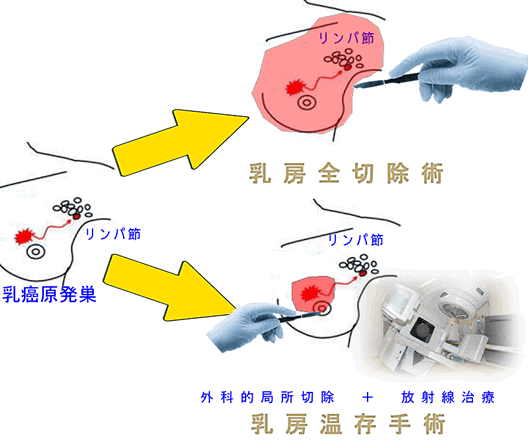
以前、「直腸癌の手術が無くなる日」で直腸癌の手術成績が以下のようであったと紹介しました。
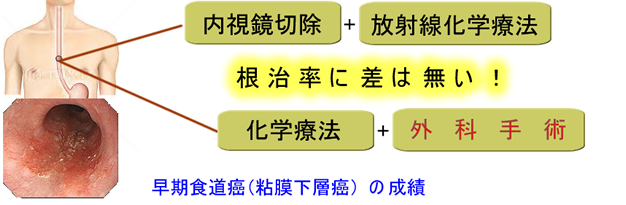
(悪)局所切除<リンパ節廓清有りの拡大切除<放射線化学療法+リンパ節廓清有りの拡大切除<局所切除+放射線化学療法(良)
つまり、リンパ節廓清には明らかに延命効果はある。しかし「リンパ節の外科的廓清」<「リンパ節への放射線化学療法」という傾向が見えてきた訳です。記事で紹介した卵巣癌での比較試験からも、これは証明されたと言えます。
もちろん「放射線や抗癌剤は使いたくない」と言う方には「外科的廓清」が選択になりますので、直ちに外科的廓清が無くなる訳ではありませんが、医学的に注目すべき事実です。
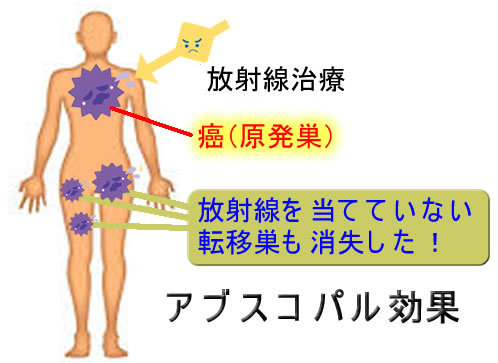
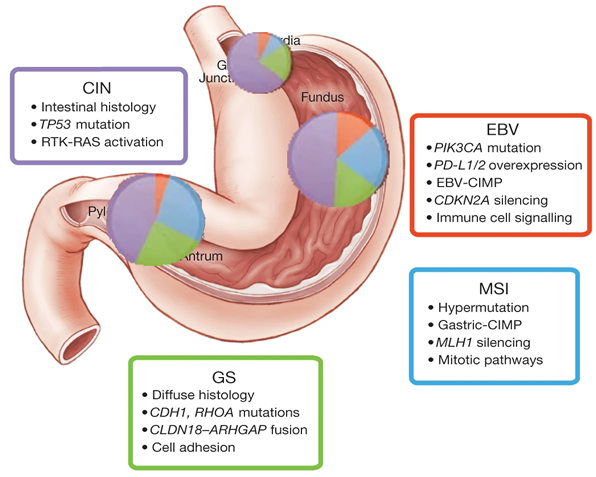
なぜ(乳癌では)放射線化学療法が良いのか?大きな理由は、以前「超早期転移モデル」で紹介したように「乳癌は早期に全身に転移する全身病である」という理論からです。この理論は現代の乳癌治療の核心となるものですが、同じく超早期転移が言われている高悪性度・大腸癌(CMS4型)や食道癌にも適応されます(下図)。
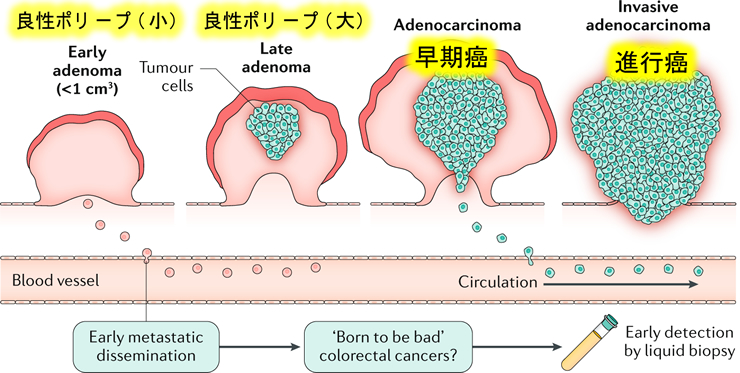
2019年Natureより
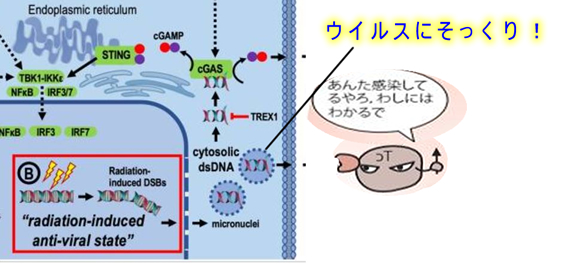
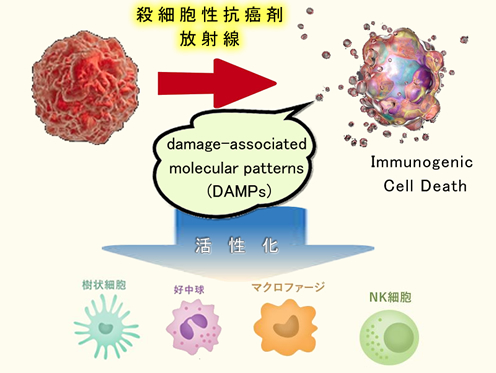
そして、もう一つの理由は以下に述べるように「免疫療法としての側面」が放射線化学療法に有るからです。