SPS(過形成ポリープ多発症),SSAP、過形成ポリープの最新情報(2021年版)
2019年にSPS/SSAPの最新情報の記事を書きましたが続報(2021年版)となります。
SPSの方の長期・内視鏡フォローについて
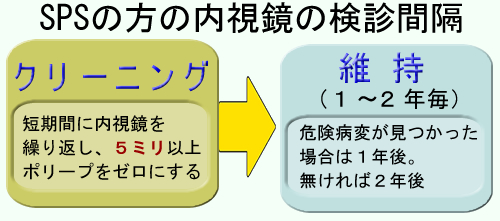
これは2019年の欧州のガイドラインです。まず「5ミリ以上をゼロ」を目指して3〜6か月毎の内視鏡を繰り返します(クリーニング)。これに続く維持期の内視鏡間隔は「3年毎だと大腸癌増加の傾向がある」「1年毎で十分に予防でき、これ以上の短縮は必要性が低い」という複数の報告から「1〜2年毎(状況に応じて)」というのが妥当な意見のようです。
このプロトコールでの10年間の追跡記録の報告/(Review)がありました。報告では実に3人に一人が、過去またはクリーニング期間中に大腸癌になっており、比較的「ハイ・リスクのSPSの方」を対象にしているのですが、維持期間中の大腸癌発生は「年間0.2%」でした。
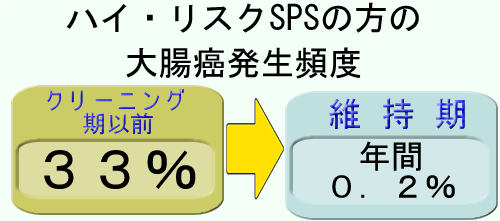
「SPSの大腸癌は予防可能であるが、早期にクリーニングを達成することが重要」「維持期が10年経てもポリープの頻度は減らずに、横這いで推移する。10年経っても油断はできない」と結論しています。
SPSの多くは「遺伝性」ではない。仮に家族性でも「単一の疾患」ではない。
「家族性重症型SPS」の原因遺伝子としてRNF43が同定されました(2015年)。当初のWHOのSPSの診断基準には「SPSの家族歴」の項目がありました。しかし、その後、遺伝子解析をしても「RNF43異常が見つかるのは極一部(約1%)」であり、多くのSPSでは原因遺伝子が同定されず「非・遺伝性」と考えられるようになりました。そして、最新のSPSの診断基準からは、「家族歴」の項目が削除されました(記事2019年 2020年)。
SPSは多数の遺伝子と「弱い相関」がある多因子遺伝であるようです(2020年)。これは肥満や高血圧と同じで「弱い遺伝性はある」という意味ですが、事実上全ての疾患は「弱い遺伝性はあり」、このような場合は「非・遺伝性」と定義されますから「SPSの多くは遺伝性ではない」と言えます。
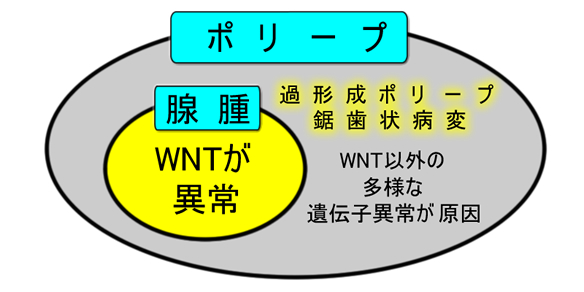
一方、少数ですが「明らかな家族性SPS」と思われる家系の方がいます。そのような「16家系」の方をゲノム解析した2021年の報告がありました。結果、見つかった原因遺伝子は細胞老化の遺伝子、ゲノム修復の遺伝子、ヒストン修飾遺伝子など、実に14種類の多岐に渡りました。つまり「患者さんの数だけ原因がある(多岐に渡る)」訳です。これは家族性腺腫症の原因がWNT系の異常(多くはAPC遺伝子)であるのと対照的です。
結局の所「SPSとは家族性大腸腺腫症ではないポリープ多発症の総称」であり「過形成ポリープ・鋸歯状病変とは腺腫でないポリープの総称」の訳です。
表面と中身の違うポリープがある(Superficially serrated adenoma =SuSA)
直腸やS字結腸の「外観が過形成ポリープと区別できない」小さなポリープが病理で腺腫と診断されることが時々あります。当院HPで掲載している以下の病変は、その典型です。一見すると「普通の直腸・過形成ポリープ」なのですが実は癌化の直前の病変(High grade Adenoma)でした。
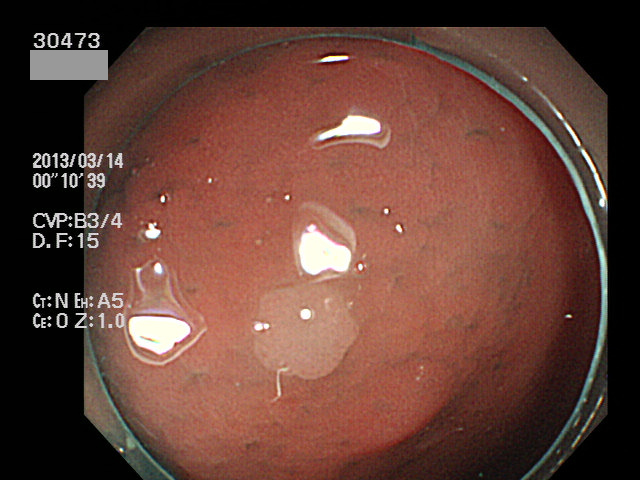
このような直腸・S字結腸に好発する「一見、過形成で実は腺腫」の病変を癌センターが詳細に解析し報告しています(2018年、2021年)。腫瘍の実態(大部分)は腺腫なのですが表面が過形成ポリープ(鋸歯状)であることから上記のようにSuSAと命名されました。このような病変の存在は「ポリープの病面を拡大観察してポリープの危険性を予測する」戦略には限界があることを意味します(以前に「過形成ポリープの取り扱いの問題」で指摘した課題です)。

(専門的)SUSAの遺伝子解析
癌センターから詳細なゲノム解析が報告されています(2018年)。「RAFではなくRASが異常。またWNT系は、APCやRNF43でなくR-SPOが異常」と報告されています。「腺腫とSSAP,TSAは何が違うのか?」、この鍵は「WNT系の異常の違い」にあるのではないか?という仮説が2020年に報告されました(下記)。この考えからは「SUSAはTSAの亜型」と言えます
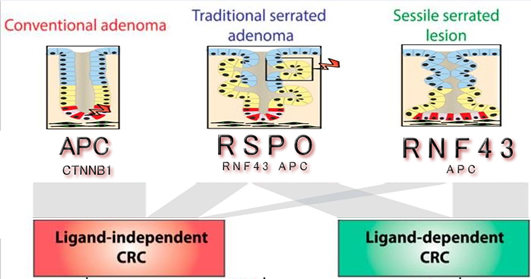 |
| WNT系の異常 |
| 腺腫 |
APC、CTNNB1 |
| TSA |
R-SPO |
| SSAP |
RNF43 |
|
(専門的)過形成ポリープとSSAPは、何が違うのか?
かっては病理学的な診断基準(拡張腺管の程度など)で、分別していましたが、現在は明確な科学的基準が確立されました。つまり「p16が正常なら過形成ポリープ、これが不活化したら過形成ポリープではない」、言い換えるなら「老化状態なら過形成ポリープ、老化が解除されたら過形成ポリープではない」という理論です。遺伝子解析は複雑で混迷しましたが、最近は、下図のような形が、ほぼコンセンサスのようです(2019年Review)。
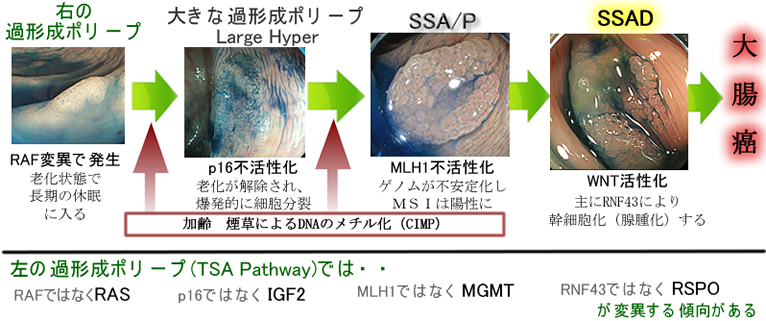
ポリープ多発症と過形成ポリープ
腺腫が癌化する過程と、過形成ポリープが癌化する過程は「最終的には」同じになります。WNTの異常が「最初に来るか?最後に来るか?」で違いが出ます
言い換えるなら
「過形成ポリープが腺腫の性質を獲得した時に」癌化し
「腺腫が過形成ポリープの性質を獲得した時に」癌化すると言えます


このような知見から
「腺腫多発症の方に発生した過形成ポリープ・SSAPは、通常の過形成ポリープ・SSAPよりも危険性が高い」
「SPSの方に発生した腺腫は、通常の腺腫よりも危険性が高い」
という事が予想されます。この予想を裏付けるような報告が2020年にありました。また家族性腺腫症の方にはTSA(=SSAPより危険な過形成ポリープ)が好発するという報告がありました(1 2)。
アスピリンの予防効果が「遺伝子組み換えマウス」で確認された
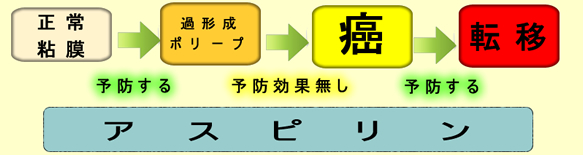
2019年の記事でも紹介しましたが「腺腫に比べると過形成ポリープ・SSAPはアスピリンの予防効果は無いのではないか?」という意見があり「論争」になっていました。
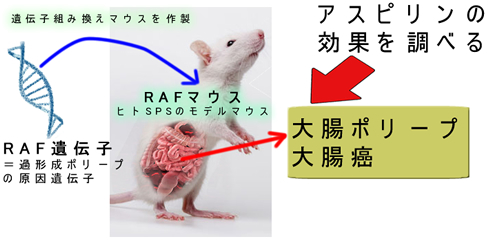
このような場合、論争に決着を付ける最終手段は「遺伝子組み換えマウス」です
遂にと言いましょうか・・・・遺伝子組み換えマウスを使った研究報告(2021年)があり「アスピリンは過形成ポリープの癌化は減らさないが、癌の転移を抑制する」と結論されました
この問題を整理します
(1)アスピリン服用者は過形成ポリープが少ないという臨床観察が複数あります(2019年記事)から「過形成ポリープの発生を抑制するのは確実」
(2)しかし一旦発生した「過形成ポリープが癌化する可能性」をアスピリンは下げない。これは「過形成ポリープはCOX2が低い」ことからハーバードのグループが主張していたことで、今回、「遺伝子組み換えマウス」でも確認された。
(3)ハーバードも「癌化の後半ではCOX2が上がる」ことを認めており、「癌化の後半にアスピリンが効くのでは」という意見があったが、これも今回、「遺伝子組み換えマウス」で確認された。
この「RAFマウス」を開発した豪州のグループから「過形成ポリープ・SSAP・SPSの重要な研究」が続々と出ています。
(1)BRAF変異がメチル化異常(CIMP)を引き起こすのに十分であることがRAFマウスで確認された(2018年)。基礎的な研究ですが実は「過形成ポリープの細胞生物学」で極めて重要な報告です。
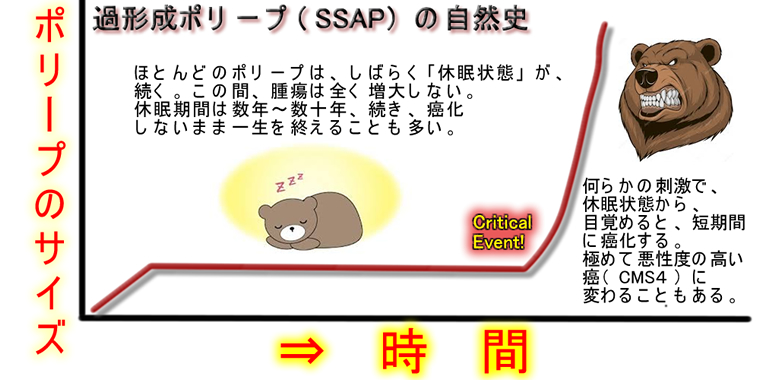
(2)「過形成ポリープがTGFβ活性化で最悪性度のCMS4に変わる」という仮説が2013年から、あったのですが、反論もありました(⇒SSAPの二つの顔)。「RAFマウス」で、この現象が再現されました(2020年)
(3)クルクミン(ウコン)がRAFマウスの癌化を予防することが確認された(2021年)。多くのサプリメントを網羅的に調べてクルクミンが最善と結論したのか、何かメーカーからの依頼でクルクミンだけを調べたのかは不明です。結論を出すのは早いのですがアスピリン、メトホルミンに次ぐ有力な癌予防薬・候補が見つかったのかもしれません。
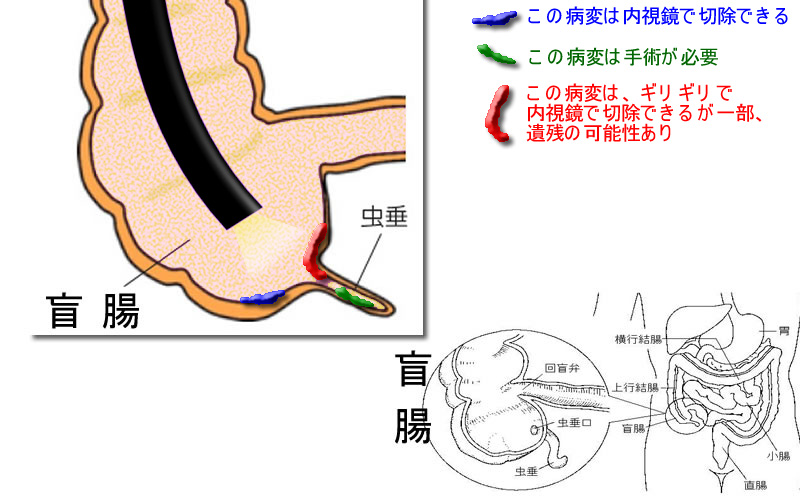
重症型SPSの方には「予防的虫垂切除」を勧めるべきという意見
これは2018年に取り上げた問題です。外科手術に至ったSPS(=重症型SPS)の68%で虫垂内にSSAPが見つかり、その26%が「異型有り」であったという報告を受けて「内視鏡フォローを受けているSPSの方へ予防的虫垂切除を勧めるべきか否か?」という問題提起がありました。結論は出ていませんが多くの専門家が注目しています。
「細胞老化」の研究が進んで「過形成ポリープが長年、大きさを変えずに休眠する」機序の解明が進んだ
これについては「老化と大腸癌予防」を、お読みください