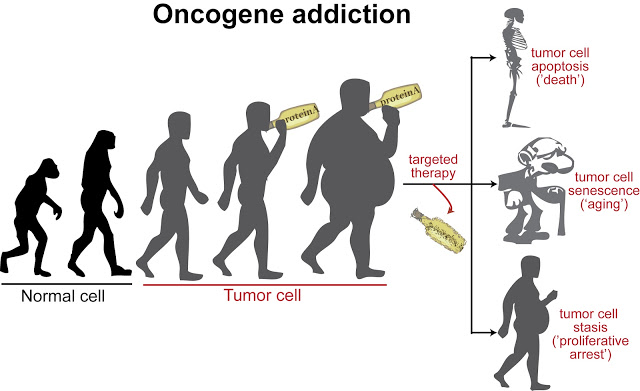
下図は2019年の記事 2018年の記事で紹介した物で、米国TCGAプロジェクト(大腸癌ゲノム解読)の結果です
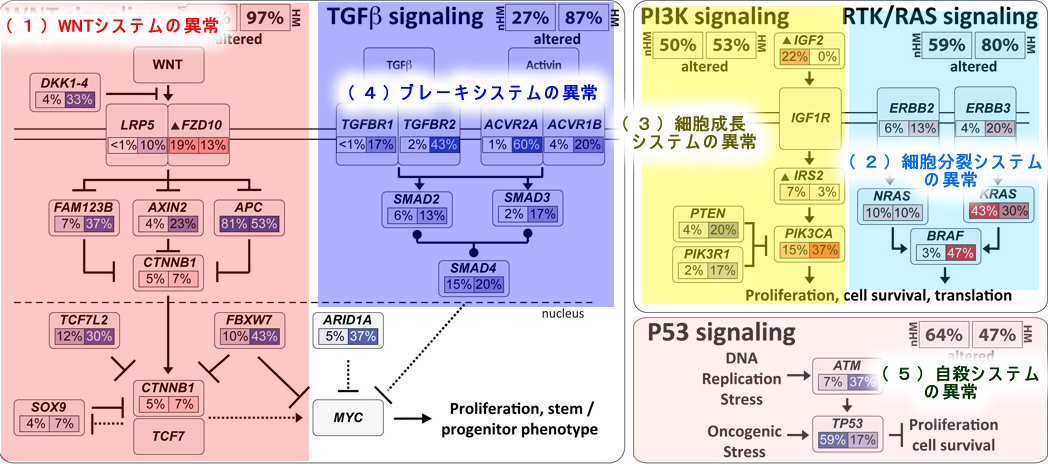
大腸癌の全遺伝子解読から、ほぼ全ての大腸癌(ポリープ)は、以下の「5つのシステム異常」により発生することが解ったのです
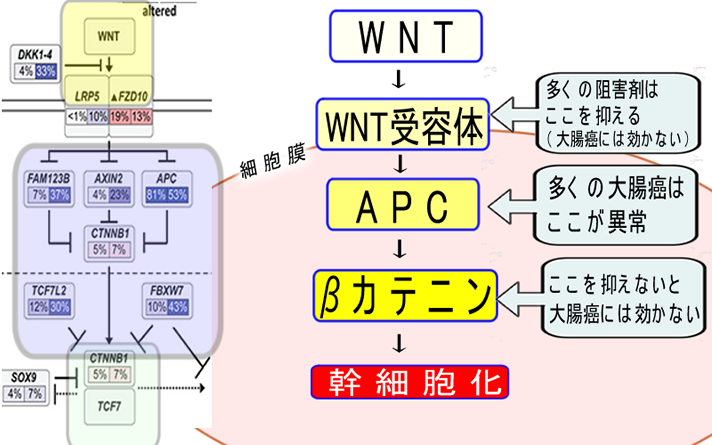
(1)WNTシステムの異常(幹細胞化)
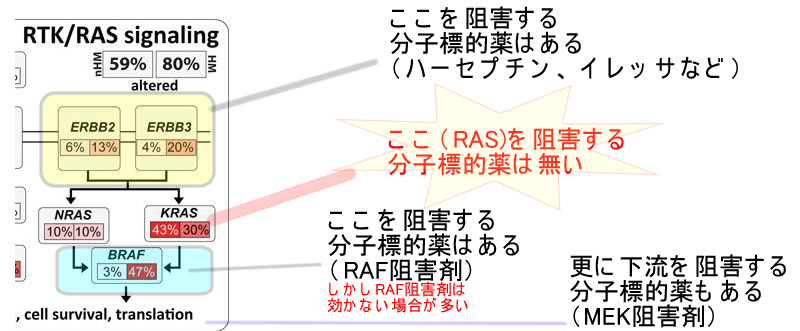
(2)細胞分裂システムの異常(RAS系の亢進)
(3)細胞成長システムの異常(mTOR系の亢進)
(4)ブレーキシステムの異常(TGFβ系の破壊)
(5)自殺システムの異常(p53系の破壊)
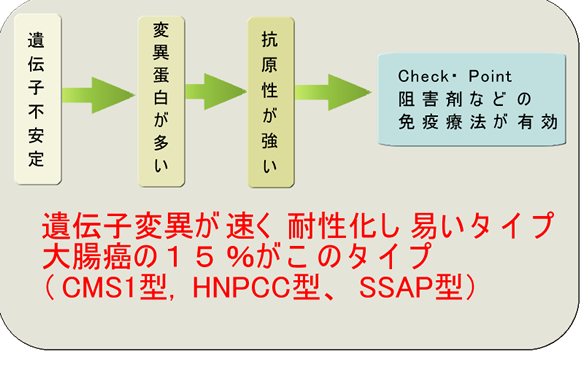
またTCGAプロジェクトでは大腸癌の中に短期間で遺伝子変異を起こし「薬剤耐性」を獲得するタイプがあることも解りました(Hypermutated Type 上図のHM型 CMS1型 全体の15%)
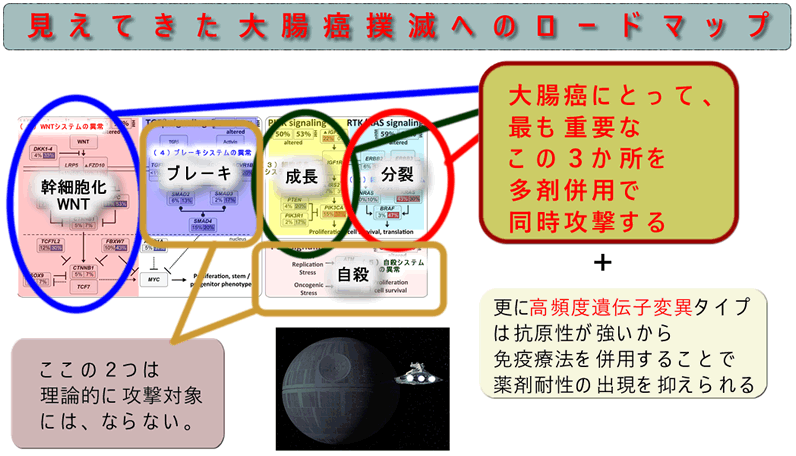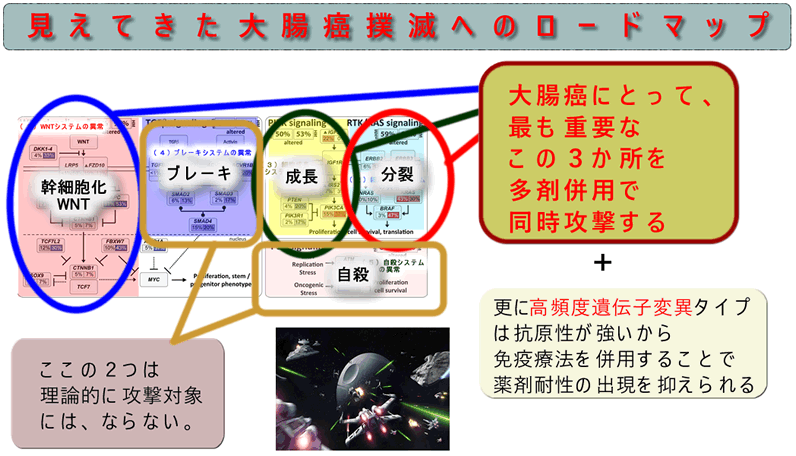
多剤併用による大腸癌撲滅へのロードマップ
上記の(1)〜(5)のシステム異常の中で (4)(5)は「機能の欠損」なので治療戦略として攻撃対象にはなりません。阻害剤による攻撃対象になるのは「機能が亢進」している(1)(2)(3)の3つです
分子標的薬の多剤併用が劇的な効果があるという報告は以前よりあり、当サイトでも8年前(2012年)に「二重攻撃が有効」という記事を書きました。
「The Cell(世界で最も権威のある細胞生物学の教科書)」は「分子標的薬の多剤併用が癌に勝利する道である」という主張で、最後を締めています(20章 p1139)。
近い将来(1)「WNT阻害剤(治験中)」(2)「RAS阻害剤(治験中)」(3)「成長阻害剤(mTOR阻害剤)」の3剤併用で大腸癌が根治される時が来るだろうと予想されます
(RAS阻害剤の代わりにRAF阻害剤、MEK阻害剤を。mTOR阻害剤の代わりにIGFR阻害剤を使うなど、複数の組み合わせがありますが、本質的にはこの3か所への同時攻撃が基本路線です 2020年最新論文)
短期間で遺伝子変異を起こし「薬剤耐性」を獲得するタイプは変異タンパクが多く、抗原性が高いために、オブジーボなどの、免疫賦活剤が有効です
上の図でWNT(幹細胞化)は受容体・阻害剤が最も作り易いタイプです(7回膜貫通型GPCRと呼ばれ、高血圧の薬など多くがこのタイプです)そのため、膨大な数の阻害剤が開発され「癌の幹細胞化を抑える」効果が確認されています(2018年レビュー)。大腸癌の場合は、やや特殊で受容体の下流で異常になっているために阻害剤の開発が、やや難航したのですが、いくつかの治験が始まっています
治験中のWNT阻害剤(大腸癌に限定
青字は受容体阻害剤。赤字は受容体
より下流の阻害剤)
| メーカー | 薬剤 |
| Novartis社 | LGK974 |
| D3-Institute社 | ETC159 |
| Oncomed社 | OMP131R10 |
| Prism社 | PRI724 |
| WntResearch社 | Foxy5 |
| Roche社 | RO4929097 |
一方、上の図の細胞分裂システムは癌化の中心現象なのですが、(分子標的薬の多くが、ここをターゲットにしています)・・・・特に中心となるRASの阻害剤の開発は難航しました
世界中の試薬会社がRAS阻害剤の開発に莫大な予算をかけましたが失敗し撤退しました。(2019年の記事) 2014年Nature誌は「RAS阻害剤はUndruggable(創薬不能)である」という記事を出しました
なぜ「RASが最も重要か?」というと、ここが「分子スイッチ(GTP結合タンパク)だからです。部屋を暗くするには「ブレーカーを落とす(ハーセプチンがこれです)」「電球を壊す(MEK阻害剤がこれです)」ことでも、達成できますが、一番、簡単で早いのは「照明のスイッチをオフにすること」です。RAS阻害剤は、これに相当します。
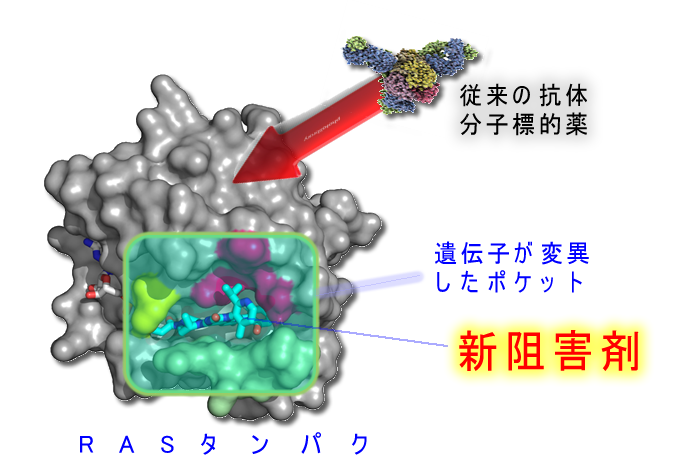 新RAS阻害剤は癌で変異した部分(K12C)に特異的に作用します。正常なRASたんぱく質には作用しないので副作用が無いのですが・・・遺伝子変異がK12C以外の場合には効果がありません
新RAS阻害剤は癌で変異した部分(K12C)に特異的に作用します。正常なRASたんぱく質には作用しないので副作用が無いのですが・・・遺伝子変異がK12C以外の場合には効果がありません