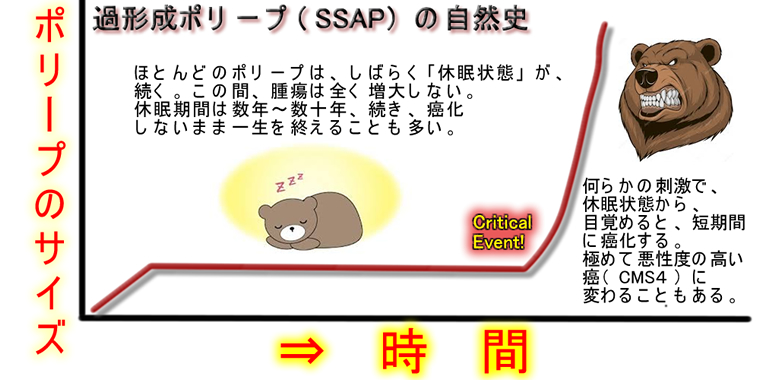
以前、「老化と癌予防」の記事で、良性ポリープの多く(特にSSAP)が、「長い休眠状態(Dormancy)」にあるという話を書きました。この休眠は、癌でも見られます。
癌の休眠(Cancer Dormacy)は、現代の癌治療で最も重要な理論の一つです(2020年Cell Revew、2021年Nature Review 、2022年Review)。
超早期転移(⇒以前の記事)を起こす乳癌が30年後のような「超晩期再発」を起こすのは、この「休眠」が長く続くためです。
2010年論文「V600EBraf induces gastrointestinal crypt senescence」
実は、「休眠」は、もう一つの現代の癌治療で最も重要な理論である「癌幹細胞」と深い関係(表裏一体)にあります。
癌は均一な細胞の集団ではなく、不均一性(Intra Tumor Heterogenity)があります。盛んに分裂するクローンと、ほとんど分裂しないクローンが混在しています。
そして「分裂しないクローン」が「休眠状態」にある「癌幹細胞」です。
大雑把には、「休眠」≒「幹細胞」と考えていいです。
重要な事は・・・
このような「休眠幹細胞」は放射線や化学療法に抵抗性があり「治療後の再発の最大原因」
という点です(完全に証明された訳では無いのですが現代腫瘍学は、この理論を重視しています)。
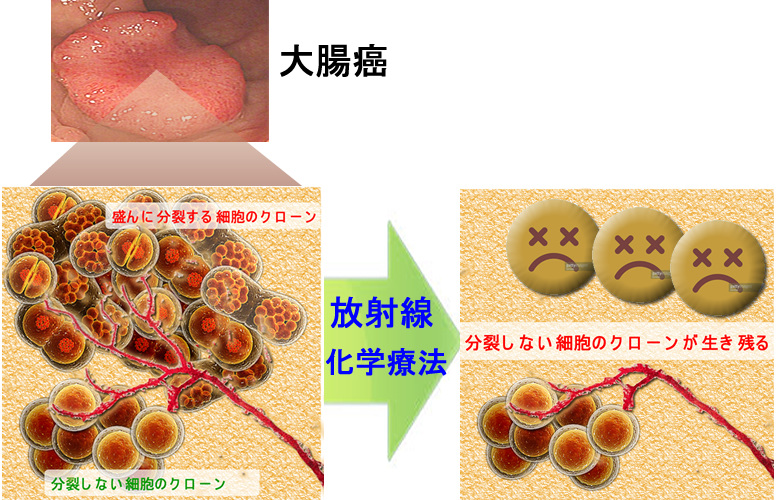
放射線も化学療法も分裂期に毒性を強く発揮します。そのため「滅多に分裂しない幹細胞」は放射線化学療法に耐性があります。
そして最近、慶應大学の佐藤博士達が、「大腸癌幹細胞」の研究で重要な報告をしました。
以前に「腸の幹細胞=Lgr5(+)」ということを書きました(⇒ポリープは老化するか?)。
今回、佐藤博士たちはまず、人の大腸の幹細胞(=Lgr5陽性)は、TGF-βにより細胞分裂を止め休眠に入るという報告(2022年 Gastroenterology)をしました。
「人結腸細胞の長期培養にはTGF-β阻害剤が不可欠である」という観察から予測されたようです。
また、この報告では「p27が休眠状態の結腸細胞のマーカー」であると報告されました。「休眠状態の幹細胞はLgr5(+),p27(+)」となります。
これは重要な知見です。休眠細胞を放射線化学療法で根絶するのは難しい訳ですが、Lgr5とp27への抗体を使った癌幹細胞根絶の治療戦略の可能性があるからです。
分化した腸の細胞の寿命が3日しかないのに、人体内でLgr5(+),p27(+)細胞は「0,6〜2.5回/年」しか分裂せず、ほとんど休眠状態です。マウスの腸の幹細胞は休眠せず盛んに細胞分裂をするために人よりも癌が出来易いと考えられています。これは「ピートのParadox」と言われる現象の理由です。
次いで佐藤博士たちは大腸癌幹細胞が「休眠する仕組み」を詳細に調べ2022年Natureに報告しました(下図)。
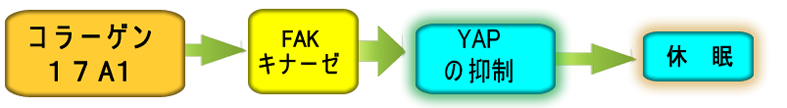
佐藤博士達の報告をまとめると以下のようになります。
| 大腸癌幹細胞に休眠を誘導することが証明された分子 | |||
| TGF-β |
コラーゲン 17A1 |
FAK kinase |
YAP阻害剤 |
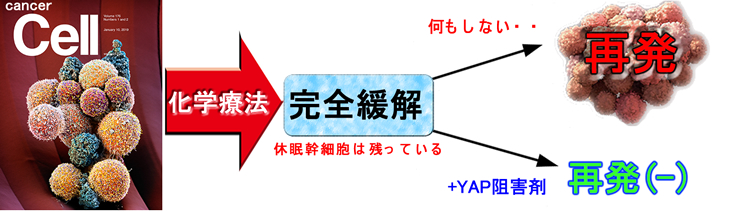
さて・・・ここからが臨床的に重要です。佐藤博士達は抗癌剤治療の後に「YAP阻害剤を追加」することで再発が減ることも報告しています。これはYAPの阻害により「休眠からの覚醒が阻止された」からと推測されます。このようなハイブリッド治療は今まで無かったもので革新的と言えます。
ここからが「controversialな難問」になります。
ここまで読まれたら「YAPを阻害しても眠らせているだけで根絶していない。解決を先延ばししているだけでは?」という疑問を持たれたと思います。
この疑問に対して佐藤博士は「癌細胞を完全にゼロにするのは不可能。コントロールできた状態で寝ていてもらう方がいい。」と述べています。
一方、逆に「放射線治療時には休眠を解除して覚醒させるべき」という報告もあります。食道癌は放射線化学療法が比較的、効くのですが、休眠クローンは「放射線抵抗性」です。この休眠は炎症性サイトカインにより誘導されます。このサイトカインをブロックして「休眠させないように前処理」をしてから放射線を当てると治癒率が上るという報告です。
分子標的薬が抗癌剤と併用されることが多いです。分子標的薬の多くは細胞周期の分子を阻害する薬剤です。これらは直接に細胞を殺すのではなく「細胞周期を止める⇒休眠状態を誘導する」のが主な作用です。従って殺細胞性の抗癌剤と併用すると、眠らせてしまい抗癌剤の効果を減弱させます。2020年に興味深い報告がありました。同時投与ではなく、殺細胞性抗癌剤投与の後に分子標的薬を追加すると効果の減弱は無く、相乗効果が期待できるという内容です。
更に分子標的薬だけでなく「免疫療法や抗癌剤自身も」休眠を誘導する(その結果、転移を促進する)というParadoxicalな現象も報告されています。

「癌の休眠の誘導」は諸刃の剣であり、起こすか眠らせるかは複雑で難しい問題です。
臨床の現場では抗癌剤・分子標的薬・放射線・免疫療法が併用されます。しかし、やみくもに併用すればいいという訳ではなく、併用により休眠が誘導され、逆に癌が生き残る危険がある訳です。
例えば放射線で治療する場合は「放射線を照射する直前は、癌を覚醒させる」べきです。しかし(放射線治療は、生涯に何度もできる治療ではありません)放射線治療が終わた後は「癌を眠らせる」方が良い訳です。このような研究は当に今、始まったばかりです。

2022年Reviewより要約
| 体内に遺残した「休眠癌幹細胞」を調べることは可能か? 例えば、乳癌が見つかり放射線化学療法を受けて癌が完全に消えた(pCR)、とします。この時に体内に「癌幹細胞が残っているか?」が調べられないでしょうか?このような癌幹細胞の遺残は、特にDTCs(disseminated tumor cells )と呼ばれます。もし、「遺残あり」なら「覚醒させて抗癌剤を再投与」します。抗癌剤が効かなかったら「癌を眠らせる療法=分子標的薬または抗ホルモン療法」に切り替えます。例え治療法が無くても今後の人生設計を立てる上で重要な情報になります。もちろん遺残が無いことが解れば無用の化学療法を回避できます。 しかしCTやMRI,PETを駆使してもDTCは検出できません。最近、血中循環腫瘍細胞(=CTC,Circulating Tumor Cell 又は循環DNA=ctDNA)を調べることでDTCsを予測できないか?という研究が盛んです(2022年Review)。このような研究も、始まったばかりです。 |
