まず2021年に興味深い報告がCellにありました。本サイトでも、何度も取り上げていますが「腺腫の癌化」と「過形成ポリープ(SSAP)の癌化」の対比です。
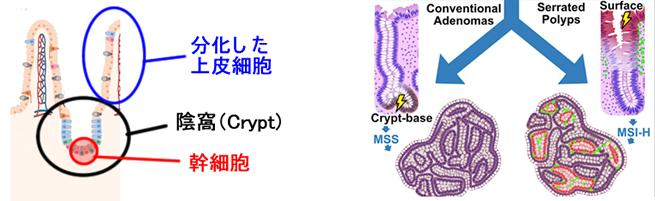
内容は、今までの報告の集大成というべきものです。(⇒SSAPの胃上皮化生、⇒腺腫は胎児化、SSAPは老化である)
腺腫は「陰窩の最深部」で「幹細胞の腫瘍化」で生まれます。
対して「過形成ポリープ」は「陰窩の表層部」で「分化した上皮細胞」が、繰り返す炎症刺激(腸内細菌が重要な原因)で「胃上皮化生」を起こすことで生まれます。SSAPやTSA(鋸歯状腺腫)の初期は過形成ポリープですから、出自は同じです。
つまり、大腸の腫瘍の出自には「幹細胞ルート」と「胃上皮化生ルート」の二つがある、という意見です。
次に2022年に日本から興味深い報告がNatureにありました。
繰り返す炎症刺激は「幹細胞の枯渇」を引き起こします。すると幹細胞に隣接する「前駆細胞(Committed)=少しだけ分化した、という意味」がリリーフとして幹細胞に変わります。これが、誤った分化をして「化生の原因となる」という報告です。報告では「p57(+)細胞」という陰窩の深部にある前駆細胞で調べていますが、他のあらゆる前駆細胞が、幹細胞リリーフとなり化生の原因になるのだろう述べています。
| 「幹細胞枯渇」⇒「幹細胞リリーフ」⇒「若返り(Reprogramming)」⇒「化生」⇒「発癌」 |
| Cellの報告では「胃上皮化生は陰窩の表層で起こる(Surface発癌)」、Natureの報告では「胃上皮化生は陰窩の深部で起こる(Bottom発癌)」という点が逆で、今後、論争になると思われます。 実は同じ論争が胃の腸上皮化生で数年前から続いていました。 胃の腸上皮化生の起源は「胃の主細胞(分化した細胞)の若返り」というのが定説でしたが、東大のグループが「主細胞ではなくて前駆細胞の幹細胞への若返りが起源」と報告したのです(2020年報告)。その後2021年には「やはり主細胞が腸上皮化生の起源」という反論が出て、2022年Reviewは従来の「主細胞説」を採用しています。決着は解りませんが日本の研究者が世界を相手に論争を起こすことは素晴らしいことです。 いずれの場合でも、分化した細胞が、再び未分化な状態に入り(若返り)、細胞分裂に入る現象はPaligenosis と呼ばれます。オートファジーにより分化細胞特異的な器官を全て消化し、細胞をリセットすること、その制御はmTORで行われていることが解っています(2018年Review)。 |
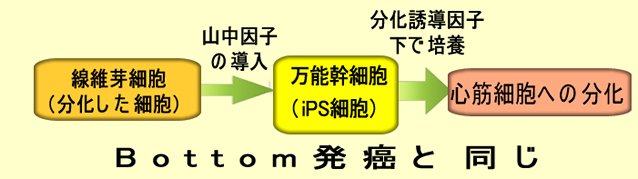
さて・・・上記の「胃上皮化生」「腸上皮化生」で提唱されている「Surface発癌」「Bottom発癌」の二つのモデルは、iPS細胞(再生工学)と共通点が多いことが解ります。
例えば「心筋梗塞後に心筋細胞を再生させる」という戦略は、以下の二通りあります。一つは「iPS細胞化」を経る方法です。
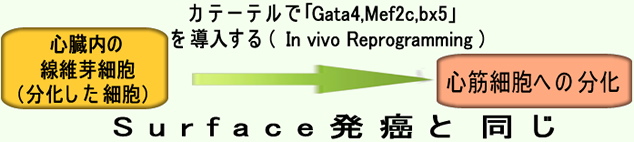
そして、もう一つは分化した細胞を、直接、他の細胞に「分化・転換」させる方法です。
いずれもマウスでは成功しており臨床応用も近い研究ですが、この二つの現象は「化生で提唱されている二つのモデル」に対応していると言えます。
| これらの現象は全て、遺伝子:DNAの変化を伴わず、「遺伝子の修飾(エピゲノム)」だけで起きます。具体的には「転写因子の正のフィードバック」と「クロマチンの変化」で「細胞の分化」が起きます。⇒発生学、幹細胞工学の基礎(The Cell 21〜22章の要約)このようにエピゲノムだけで細胞の分化状態を劇的に変える操作を「再プログラム(Reprogramming)」と呼びます。カテーテルなどを使い、成体内で直接、細胞の分化状態を変える操作を「In vivo Reprogramming 」と呼びます。 個体の老化は、ゆっくりと進行する「自然のIn vivo Reprogramming 」と言えます。iPS細胞の作製は、逆の「若返りのReprogramming 」と言えます。 |
2018年に山中因子によるReprogrammingにより化生(膵臓のADM化生)が起き、膵臓癌の危険が上がるという報告が京大のiPS研究所からNatureに発表されました。報告した山田博士は「iPS化と癌の関係」を研究されている方です。
In vivo reprogramming drives Kras-induced cancer development
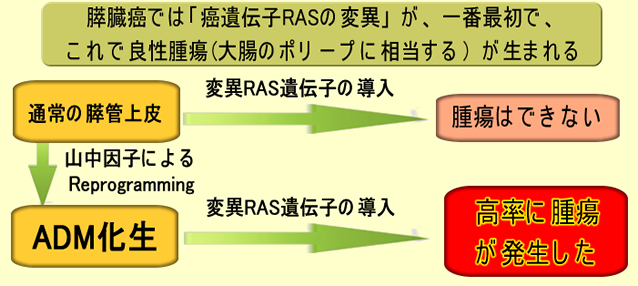
この複雑な話題は、現在、専門家で議論になっています(2022年Review)。
| 追加事項:未分化癌・胎児様癌の起源 消化管には、極めて稀ですが「未分化癌」という「内胚葉の特質」を完全に失った癌や「中胚葉・外胚葉成分を含む奇形腫的癌(胎児様癌)」が見られることがあります。おそらくは「若返り(Reprogramming)」により発生したか(2008年 Nature)、我々の体内に潜んでいる万能幹細胞(MUSE細胞)のような細胞が起源かもしれません(頻度は極めて稀でありMUSE細胞が危険という意味ではありません)。 |
「若返りのReprogramming」は実験室でiPS細胞を作製する時だけに起こる「特殊で不自然な現象」ではなく、我々の体内で日常的に起きている現象なのかもしれません。
ここ、2〜3年、「山中因子を導入することで老化したマウスを若返らせることに成功した」という報告が相次いでいます(Cell 2017年 Nature 2020年 Nature 2021年)。個体を若返らせることは、山中因子を使えば「実は想像以上に容易であった」ということです。
臨床応用に近いIn vivo Reprogrammingの決定版と言える報告がNature 2020年にありました。アストラゼネカのコロナワクチンと同じ方法(一過性発現型ウイルスベクター)で山中因子を導入し 、老化したマウスの視力を回復させることに成功しました(下図)。
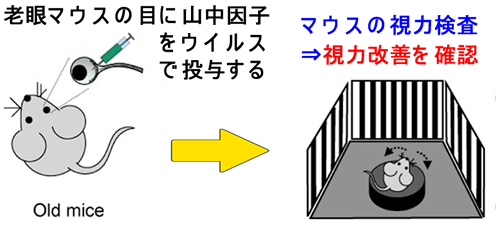
再生工学の進歩には驚くべきであり、今後は「若返り In vivo Reprogramming 」は激しい国際競争になるでしょう。一方、この現象には「化生」という不都合な副産物が伴うことも明らかになった訳です。

山中博士がノーベル賞を取られた時、私は「心臓や脳の再生医療が始まる。でも、自分の専門領域(消化管)は、関係無いな・・」と思いました。しかし、それは間違いで、消化管の分野で長い間、重大な謎であった「化生」という現象の解明につながった訳です。
我々消化器医は、長い間「化生を老化現象」と思っていました。しかし、実は、これは「我々の体内で、日々起きている若返りの随伴現象」だった訳です。
