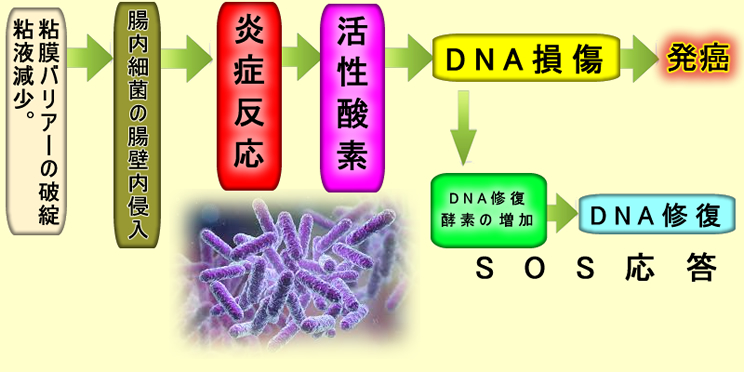
「潰瘍性大腸炎⇒発癌」の古典的なモデルです。細菌自体が発癌性を持つ場合もあります(⇒コリバクチン)が、我々の免疫系が作る殺菌性成分(活性酸素あるいは窒素)が最大の発癌物質であるというモデルです。遺伝子に傷が見つかると細胞は修復酵素を増産してDNAの損傷を修復します(SOS応答)。2015年のノーベル化学賞は、このような「DNA修復機構」の解明に贈られました。
潰瘍性大腸炎の癌化は「内なる敵」が原因だった
今回のテーマは「基礎医学の話題」ですが、将来は「癌予防の要」になると期待されている分野です。
何故、長期炎症が発癌(DNA変異)を起こすのか?・・・・古典的な「外因性発癌」モデル
「潰瘍性大腸炎⇒発癌」の古典的なモデルです。細菌自体が発癌性を持つ場合もあります(⇒コリバクチン)が、我々の免疫系が作る殺菌性成分(活性酸素あるいは窒素)が最大の発癌物質であるというモデルです。遺伝子に傷が見つかると細胞は修復酵素を増産してDNAの損傷を修復します(SOS応答)。2015年のノーベル化学賞は、このような「DNA修復機構」の解明に贈られました。
抗炎症薬・免疫抑制剤は潰瘍性大腸炎の発癌(Colitic Cance)を、本当に予防するのか?
この古典モデルは重要な問題を提起します。潰瘍性大腸炎の治療薬は免疫・炎症を抑えますから細菌の侵入を長期化させて有害なのでは?むしろ発癌を促進するのではないか?という疑問です。「5-ASAはColitic Canceを予防しない(2011年)」という報告、「5-ASAは予防するがチオ・プリン(免疫抑制剤)は予防しない」という報告(2017年)」「短期間では5-ASAの予防効果は無い」という報告(2007年)などがありました。過去の複数の研究を総合(メタ解析)して、「抗炎症薬・免疫抑制剤は潰瘍性大腸炎の発癌を予防する」という結論が出たのは、比較的最近です。「広範囲に作用する免疫抑制剤では無く、特定の有害なサイトカインだけを抑える方が有益だ」という思想からTNF抗体療法は発癌予防が期待されており、最近、有望な報告も出てきましたが、最終結論はまだです(2021年予防法のReview)。
煙草はColitic Canceを予防する
以前から指摘されていたことですが最新のメタ解析でも、予防効果が確認されました。これはニコチンが潰瘍性大腸炎を抑えるからで、煙草の発癌物質(ベンゾピレンなど)が無害であるという意味ではありません。潰瘍性大腸炎の方で禁煙できない喫煙者はニコレットなどのニコチン製剤に切り替えることが強く推奨されます(2020年Review)。
新しいモデル。細胞は自らDNAを変異させる酵素を造り、積極的に遺伝子に変異を導入する ・・・「内因性発癌」モデル
以前の記事(⇒ゲノム不安定性)で、紹介しましたが、細菌は環境変化などのストレス下で積極的に自らのゲノムを変異させて生き残りを図るという現象(Stress-Induced Mutagenesis:SIM/adaptive mutation)が2012年に提唱されました。
そしてSIMシステムは哺乳類の細胞にも、しっかりと残存しており癌との関連があることも解りました(2019年Science 2020年Science)。SIMの詳細な機序が 2019年Cellに報告されました。過剰に発現するとゲノムを変異させるタンパク質=DNA “damage-up” proteins (DDPs)と命名されたタンパクは280個に及びますが、内訳は「活性酸素を産生する酵素(これは想定内)」以外に「DNA複製に関わる酵素」「DNA修復酵素」などもDDPであることが解りました。「DNA修復酵素がDNAを変異させる」という不思議な現象については下記(哲学的な話)で解説します。
京大の本庶佑博士はAIDという酵素で抗体に多様性(変異)が導入される現象を発見しました(本庶博士はノーベル賞を受賞したオブジーボが有名ですが、実は博士の最も偉大な研究はAIDの発見で、こちらもノーベル賞級の研究です)。
そしてRNA編集という「酵素がRNAを変異させる現象」が、脳のイオンチャンネル(ADAR)とリポタンパク(APOBEC)で見つかりました。そしてAIDが行うDNA編集とRNA編集は類縁の酵素であることが解り、現在はAPOBECファミリーと呼ばれます。APOBECは「元々 レト ロウイルスやレトロトランスポゾンに対する防御機構として進化し, 後にそれを特定の mRNA のもつ意味を変えることに転用された(1 つの遺伝子から複数の微妙に違った タンパク質を作るための “手抜き法”)」というのが現在の定説です(The Cell第7章 p.419)。まとめると下図のようになります。
APOBECは自らのゲノムも変異させる諸刃の剣か?
一見するとAPOBECは非所に危険な「諸刃の剣」に見えますが、我々のゲノムは何重もの「修復システム」を持つために害は少ない訳です。そもそも「変異原物質=ゼロ」の理想的環境でも、1個の細胞に1日当たり約3万個以上の変異が発生しており(The Cell 第5章 p267)、我々の細胞は、これらを毎日、全て修復していますから・・・APOBECの発現が増えたからと言って直ちに脅威にはならない訳です。
「メチルシトシンの脱アミノ化」というセキュリティー・ホール
しかし・・・このような何重ものDNA修復システムにも「セキュリティー・ホール」と言うべき重大な欠陥があります。シトシンがメチル化されて、更にAPOBECが作用すると「修復不可能」になるのです(下図)。
人の遺伝病や癌の原因のDNA変異の多くが、この「メチル・シトシンの欠陥」に起因することも解りましたが、この欠陥が表面化するのは老人になってから(生殖を済ませた後)ですから、この欠陥は進化で残ったのでしょう。またこの欠陥は「進化には有利」に作用しました(下記「哲学的な話」)。
The Cell 第5章 p267より
APOBECはColitic Cancer、更に消化管の「炎症癌」に広くに関与している
APOBECがColitic Cancerに関与しているという報告は以下の2編があります
(1)2008年 腸上皮にTNF⇒NF-kB⇒APOBEC(AID)という経路がある。腸上皮でAPOBEC(AID)上昇⇒p53変異になる。潰瘍性大腸炎の粘膜ではAPOBEC(AID)が増加している(免疫染色)。
(2)2012年 IL-10欠損マウス(UC⇒Colitic Cancerを自然発症する)のAPOBECをノックアウトマウスは(炎症は変わらないが)、癌の発生、p53の変異が抑制された。
尚、APOBECを欠損させるとAPCマウス(通常型大腸癌のモデル)でも大腸癌が減少する(2007年)ので、APOBECの関与はColitic Cancer特異的では無いようです。
2007年のNatureに京大から「胃炎ではピロリ菌感染⇒APOBEC発現⇒p53変異」が起きていると報告されました。現在では、潰瘍性大腸炎、ピロリ菌感染の慢性胃炎、バレット食道炎などで広範囲に「慢性炎症⇒APOBEC発現⇒p53変異」が起きていると考えられています(下図)。
2021年Review より
何故APOBECが誘発されるのか?・・・・内在性ウイルス?
上記レビューにあるようにSTAT6やNF-kBなどの「炎症シグナル」がONになるとAPOBECの発現が増加することが解っています。しかし、この現象のもつ「生物学的(進化的)な意義」は何でしょう?
APOBECは「元々 レト ロウイルスやレトロトランスポゾンに対する防御機構として進化した(The Cell第7章 p.419)」というのが有力な説です。以前「潰瘍性大腸炎とトランスポゾンの関係」の記事を書きましたが、「内在性ウイルス(トランスポゾン)⇒APOBEC⇒自己免疫疾患、発癌」という仮説モデルが出来つつあります。
文献
- Expression of APOBEC family members as regulators of endogenous retroelements and malignant transformation in systemic autoimmunity
- Post-transcriptional regulation of LINE-1 retrotransposition by AID/APOBEC and ADAR deaminases
- Retroviruses drive the rapid evolution of mammalian APOBEC3 genes
- Differential inhibition of LINE1 and LINE2 retrotransposition by vertebrate AID/APOBEC proteins
- Human APOBEC3G Prevents Emergence of Infectious Endogenous Retrovirus in Mice
潰瘍性大腸炎で最初に起こる現象はトランスポゾン活性化ということになります。では何故、トランスポゾンは活性化するのか?トランスポゾンを抑えているのはSETDB1であり、一番最初に起こるのは「SETDB1の機能不全である」という報告が最近あります。
文献 2021年GUT SETDB1 is required for intestinal epithelial differentiation and the prevention of intestinal inflammation
2020年Nature Gut stem cell necroptosis by genome instability triggers bowel inflammation
但しSETDB1は一つの候補です。他にTrim28、KRAB-Zip(2020年,)Sub39a,HUSH,SLFN14,Rhox など複数の「トランスポゾン抑制因子」が見つかっています。ウイルスは、これらに拮抗する因子を身に着け、更に宿主は、それを抑える因子を身に着ける、ことを繰り返してきました。これらは宿主とウイルスの何十億年もの「軍拡競争」の名残なのです(The Cell)。これらの防御因子の機能不全は全てトランスポゾンを活性化します。それらの自己免疫疾患への関与の解明は、始まったばかりであり、今後の課題です。
RNAという未知の分野
m-RNAワクチンでシュードウリジン修飾RNA(ΨーRNA)が有名になりましたがRNA編集(科学修飾)は、依然、未知の世界です。「リボゾームRNAは核小体のsmall nucleolar RNA:snoRNAで100箇所近くで化学修飾を受けるが、その意義は謎である。」(The Cell 6章p328)。
The Cell第7章 には「A(アデニン)⇒I(イノシン)を起こすADAR(Adenosine deaminase acting on RNA)の方がAPOBEC(C⇒U)よりも一般的である」とあります。ではADARは癌に関係するか?これはYESで、ADARの低下(編集不足)、ADARの増加(過剰編集)の両方が多様な癌で報告されています(⇒2019年Review)。
(専門的)最後に哲学的な話を・・・
生命が自らのDNAを積極的に変異・破壊する機序(DNA Damegeシステム)を持っているという話は驚くべきことですが、実は不思議な話ではありません。そもそも「DNA修復酵素」というのはDNAの誤った部分を切断し削り取ることから始まります。「DNAを切断する」という過程は放射線でDNAが損傷を受ける過程と同じです。つまり「DNA損傷」と「DNA修復」は表裏一体の関係にあり、「異常では無いDNA」に「DNA修復酵素」が作用すると「DNAの変異」となります。では「コドンが正常か?異常か?」の判定は容易かと言うと実は、これが難しい訳です。
我々多細胞生物の体内では細胞のDNA破壊は極力、抑えられています。しかし、精巣・卵巣ではこれが一転します。精子・卵子は「減数分裂」という過程を経ますが、この時、染色体に何か所もの切断が入ります。この切断は我々が持つ「最恐のDNA破壊者=Spo11」がおこないますが、この過程はDNAの放射線障害とほとんど同じで、父方染色体と母方染色体が複雑に混ざりあってモザイク状の染色体を造ります。変異と進化は表裏一体なのです。
メチルシトシンというセキュリティー・ホールが何故、残っているのか?メチルシトシンの多くは遺伝子の非翻訳領域(=転写調整領域)に存在します。そのため、このセキュリティー・ホールは重要な遺伝子自体を破壊することは稀であり非翻訳領域(=転写調整領域)の変化⇒遺伝子の発現様式の変化、という形で現れます。実は脊椎動物以降の高等生物の進化の内容は、多くが「転写調整の進化」であり、タンパク質自体は、ほとんど進化していないとThe Cellにあります。メチルシトシンというセキュリティー・ホールのお陰で人類も生まれた訳です。