大腸ポリープ・ポリクローナル発生説の検証
1年前に「大腸ポリープはポリクローナルに発生する」という衝撃的な論文を紹介しました。その時は「コペルニクス的な論文だが真偽は追試を待たないと解らない」と書きました。その後、同様の報告が相次ぎました(下記 )。どうやら「地球が動いていた(主張は正しかった)」ようでポリクローナルモデルが「定説」になりつつあるようです。
- Polyclonal-to-monoclonal transition in colorectal precancerous evolution(1年前に紹介した論文)
- Polyclonal origins of human premalignant colorectal lesions(Nature)
- Polyclonality overcomes fitness barriers in Apc-driven tumorigenesis(Nature)
- Crypt density and recruited enhancers underlie intestinal tumour initiation(Nature)
- Temporal recording of mammalian development and precancer(Nature)
- Redefining familial adenomatous polyposis: competition, cooperation, and
the path to monoclonality(Review)
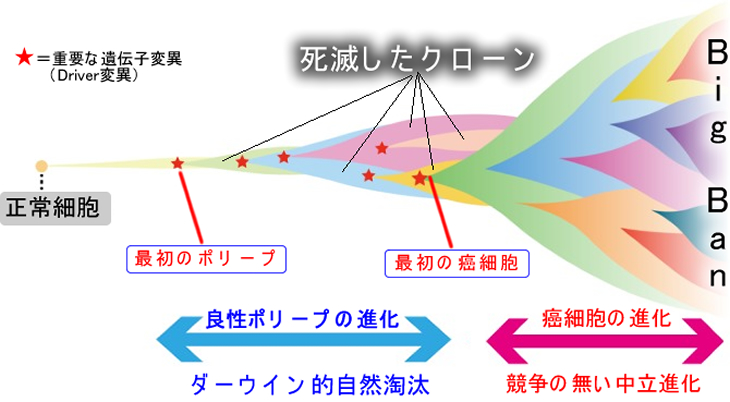
従来の「モノクローナル」モデル(2021年記事より)
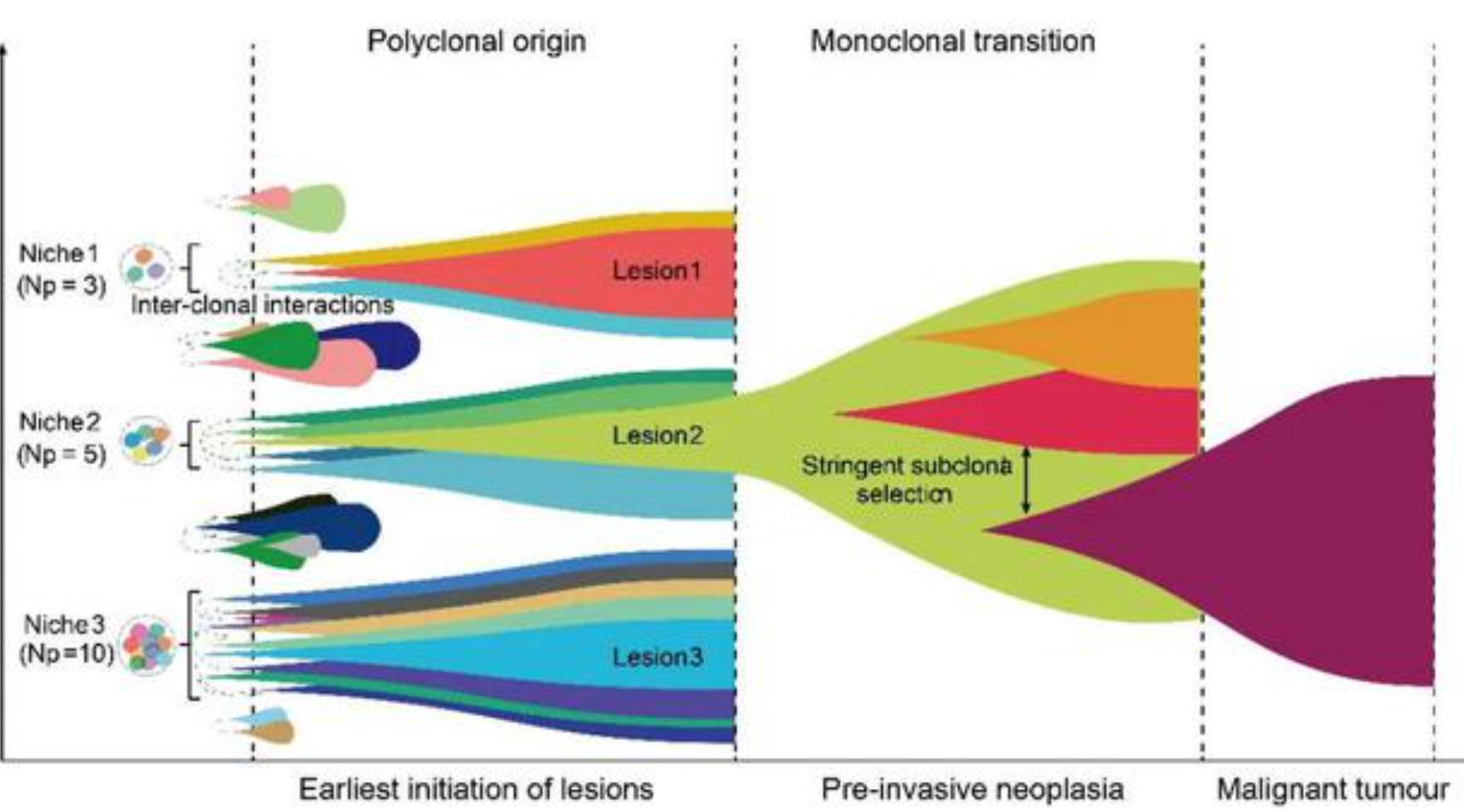
「ポリクローナル」モデル(2024年のNature) ポリープはポリクローナルで発生しますが進行するとモノクローナルになります。今までは、大きめの病変を解析していたので「ポリープはモノクローナルだ」と思われていたのです。極めて微小な初期病変を調べて、初めて「ポリクローナル」であることが明らかになりました
この問題の持つ課題を以下の5点に整理しました
- ポリクローナルになる理由は何か?
- なぜモノクローナルなポリープは見つからないのか?
- 大腸以外の腫瘍もポリクローナルか?
- 癌の診断の考えが根本から変わる
- 癌の予防の考えが根本から変わる
ポリクローナルになる理由は何か?
当初、この現象はFAPで見つかりました。それで腫瘍性陰窩の密度が高いために「偶然に起きた衝突の結果(生物学的な意味は無い)」という意見もありました。しかしFAPではない通常の腺腫でも見つかることから否定されました。
次に周囲間質の細胞(線維芽細胞や免疫細胞)が腺腫にできやすい微小環境を作るからポリクローナルになるという「フイールド」説が出ました。しかし、これも「あるのですがメインではない」ようです。
異なるクローン(陰窩)が近接するとクロマチン構造が激変することから「ポリクローナルな細胞同士の協力関係」が腺腫の発生には不可欠であることが解りました(文献4)。
この「強力関係」の正体は何か?が現在に研究の最大課題です。
各クローンが微妙に異なる液性因子(Notumなど)を分泌して協力関係が構築されているのだろうと予想されています。そのような因子は強すぎても弱すぎても生存に最適ではなく、複数が組み合わさり、最適なレベルになるというモデルです(Just-Rightモデル)。
なぜモノクローナルなポリープは見つからないのか?
我々の大腸は正常に見えますが実は10万個のドライバー変異を持つ陰窩(Aberrant Crypt Foci=ACF 当然、これはモノクローナル)が存在します(2019年Nature この現象は大腸だけでなく老化に伴い全身の臓器に見られます)。
では、なぜ我々の腸には10万個の腺腫が発生しないのか?
これはモノクローナルでは上記の「協力関係」が生まれないからです
「10万分の1」の確率で複数クローンが隣接して発生した場合に「協力関係」が生まれ肉眼的なポリープまで成長するのです。
癌遺伝子変異(ドライバー変異)=腫瘍発生ではなくて、そこに「確率論的な制限(複数クローンの隣接)」があるのです。
大腸以外の腫瘍もポリクローナルか?
膵臓癌の超初期病変(PanINs)は多発性に発生します。その大部分はモノクローナルなのですが、一部がポリクローナルであると、2024年Natureで報告されています。これを取り上げて文献2の「Discussion」では「大腸以外の臓器の初期病変もポリクローナルなのではないか?」と問題提起をしています。しかし、これを証明するには「微小な初期病変の検出と解析」が必要であり、大腸以外の臓器では、そのような研究が進んでいないので難しいでしょう
癌の診断の考えが根本から変わる
我々の大腸には「無害な10万個の癌遺伝子異常細胞(モノクローナル)」が存在します。このうち、臨床的な意義を持つポリープまで進行するのは数個です。しかし「便中DNA検査」「血中DNA検査」などの最新バイオマーカー検査は、これらの「無害な異常細胞」も検出します。以前から「バイオマーカー検査は感度が高すぎて現実的ではない」と批判されてきましたが、その問題が明白になった訳です。「遺伝子診断から古典的画像診断へ回帰」が起こるかもしれません。
癌の予防の考えが根本から変わる
今までの癌予防は「発癌物質を避ける」ことに重点が置かれていました。しかしポリープ発生を決める最も重要な「律速段階」は最初の腫瘍細胞の発生ではなくて「複数のクローンの協力」であることが解ったわけです。この「協力関係の阻止」は「発癌物質を避ける」こと以上に効果的かもしれません。現在、この効果があると予想されているのが「リチウム」と「アスピリン」です。リチウムはNotumを抑制し「Supere Compete」を抑えます。アスピリンはポリクローンが協力して作り出す微小環境(微小炎症)を抑えます。
発癌のモデルが根本から、変わるので診断法・予防法も根本から再検討されるでしょう。(当にコペルニクス的革命)



