ポリープが癌化する過程で、どのような遺伝子異常が起こるか?これは、ほぼ100%解明されています(APC、RAS、p53・・・・など)
これらの異常遺伝子を正常細胞に導入すると「完璧な大腸癌」になります(リバース・ジェネティクスと呼ばれる手法です)(下図 2017年)
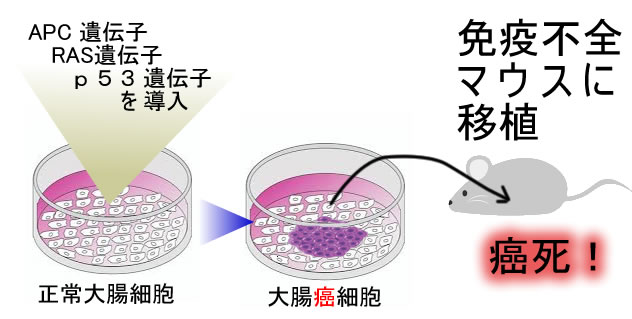
これらの実験から「上記の遺伝子異常が大腸癌発生に必要にして十分な条件」であるように見えるのですが・・・・
なぜ我々の大腸には15万個の癌が発生しないのか?
2020年の記事で「正常組織の細胞の網羅的な遺伝子解析」の報告を紹介しました
我々は皆、大腸に15万個の微少な前癌病変(癌遺伝子の変異した幹細胞=陰窩)を持っていることが分かりました。
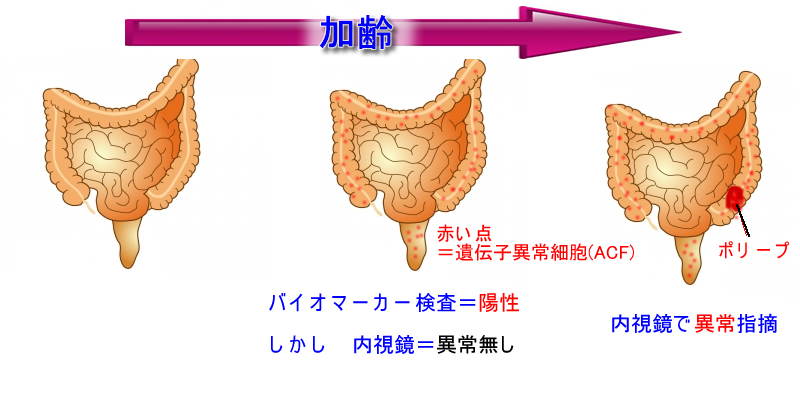
日々、細胞分裂が続く腸の細胞には高頻度で遺伝子異常(複製エラー)が発生しているが実際の体内では、その多くが癌化に至らず前癌状態で止まっているのです。
この癌化阻止が「免疫によるものらしい」という知見が最近、蓄積されつつあります。
粘膜内癌の3分の1は免疫応答により「消滅」する
この「免疫による癌化阻止」は肺の扁平上皮癌で2019年にNatureで報告されました。非浸潤性病変(粘膜内癌)が浸潤性の癌に移行する段階で最も強力な免疫応答が起きます。そして免疫回避(チェックポイント)を起こせた粘膜内癌だけが浸潤癌になれる訳です。2020年には具体的な分子変化も報告されました。粘膜内癌で浸潤癌に移行するのは「半分」であり、3分の1は免疫により消滅するとのことです。
以上は肺癌の話ですが、大腸でも以前から「自然消滅」の報告があり、おそらくは似た状況と予想されていましたが、最近、その確証となる報告が出てきました
MSI(マイクロサテライト不安定)ポリープは免疫で排除される
MSI陽性の大腸癌は抗原性が強いため免疫反応が起きやすく免疫回避(チェックポイント)により攻撃を受けずに済んでいます。オブジーボなどのチェックポイント阻害剤により免疫攻撃が始まると癌が排除されます。上記の肺癌の話からチェックポイント阻害剤の効果は進行した癌よりも粘膜内癌が浸潤する初期段階が最も有効と推測されます。2023年にリンチ症候群の患者さん(=腫瘍はMSIになります)に発生した大きなポリープがPD1阻害剤で消滅すると報告されました。鋸歯状病変(過形成ポリープ、SSAP)の癌化でもMSIがカギになるので(⇒2019年報告)、同様に粘膜内癌(SSAP with Dysplasia)がPD1阻害剤で消滅すると予想されます
上記はMSI(+)の「特殊な大腸腫瘍」の話ですが・・・
一般的なMSS(マイクロサテライト不安定性無し)のポリープも免疫で排除されるのでしょうか?
2023年には一般的な大腸腺腫の癌化でICOSという分子が重要であることが報告されました。ICOSはTreg(抑制性T細胞)を誘導する分子で、PD1と共同で「免疫を抑制」します。
そして決定的と言える研究が2024年8月のNatureで報告されました。MSS型では「TIGIT(PD1と類似のチェックポイント分子)⇒γΔT細胞」という経路での免疫抑制が働いているという報告です。オブジーボは使えませんが「TIGIT阻害剤」がMSS型大腸癌に有効であるという話です。
以上の報告は「チェックポイント阻害剤による大腸ポリープの癌化の予防」という全く新しいアプローチの可能性を示唆するものです
失敗したポリープ予防ワクチン
進行した癌では強固な免疫抑制環境が構築されてしまっているために「初期の病変が免疫療法の重要対象である」という考えが出てきています。チェックポイント阻害剤ではなくMUC1という「大腸ポリープに高発現する分子」をワクチンにするという試みがあったのですが2023年の報告ではポリープ予防効果は確認できませんでした。
チェックポイント阻害剤を予防的に投与する時代が来るかもしれない
進行した癌の治療よりも「予防的投与」の方が遥かに大きな効果が期待できます。当然、それには「チェックポイント阻害剤の薬価の大幅低下」が必要ですが、これはジェネリック薬品の大量生産で可能でしょう。2024年のNatureの高齢マウスを使った実験ではチェックポイント阻害剤の「予防的投与」は副作用(炎症、自己免疫)を起こさず感染防御を高め生存期間を延長しました。
私見ですが全身投与には副作用のリスクがありますが内視鏡を使えば大腸への局所投与(例えばチェックポイント阻害剤の局注)も可能です。
以前、「癌遺伝子ワクチン成功」の記事を紹介しましたが、「免疫によるポリープの治療・癌化阻止」は今後の発展が非常に期待できる分野と言えます
