30年前は「食道癌・胃癌はDe Novo発生なのに、何故、大腸だけが多段階発癌で前癌病変(=ポリープ)があるのか?」が謎で、日本の学会では激しい議論がありました(⇒「大腸癌の構造」)。
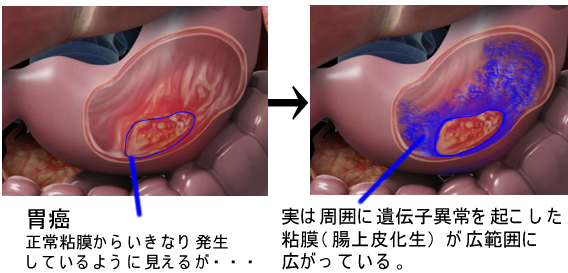
しかし、今日、この問題は解決しています。De Novoのように見える胃癌は実は腸上皮化生という前癌状態を経る「多段階発癌」であり、食道癌も又「食道炎⇒過形成⇒異型上皮⇒癌」という「多段階発癌」である(1,2,3)ということが解明されたからです。尚、胃・食道ではField cancerizationとも呼ばれます。
| 大腸癌が多段階発癌である分子生物学的証拠 |
大腸癌のゲノム解析から5つのシステム異常が大腸癌の原因(メイン・ルート)であることが証明されました(⇒第4のポリープはあるか?)。そして、この5つの異常を人工的に導入する実験(Riverse Geneticsと呼ばれます)で、この5つが癌化の「必要かつ十分な条件」であることが証明されました(下図:2017年文献:RAS,PI3Kの代わりにEGFRも使用)。これが、5 Step発癌がメイン・ルートであることの証拠です。 |
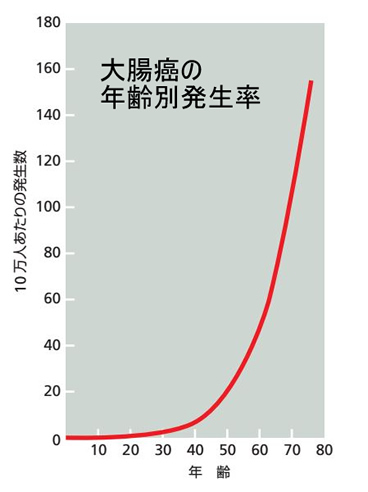
大腸癌の発生率は加齢で指数関数的に増加します。これは「数学的な多段階発癌の証拠」と考えられています(The Cell 20章 p1095)。
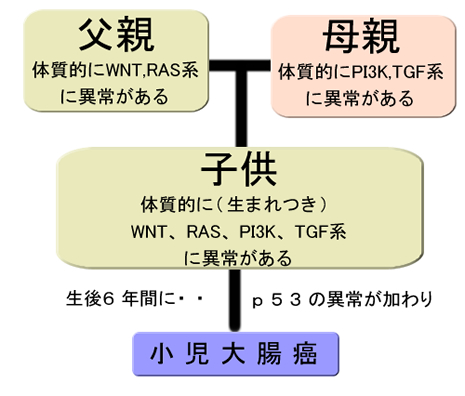
現時点で世界で報告されている最も幼少な大腸癌は「6歳の少年」です。このような場合は、体質的なゲノム不安定性が、根底にある場合が多いです。ゲノム不安定性以外では下図のような要因だろうと考えられています。
以上から「(遺伝的に特殊な場合を除けば)通常は大腸にはDe Novo癌(One Step癌)は実在しない」と予想されています。
p53が変異した癌はDe Novoではない
高悪性度・低分化癌(印鑑細胞癌、Colitic Cancer、De Novo様の大腸癌など)の遺伝子解析では「p53が早期に異常になる」という現象が共通で報告されています。
しかしp53だけでは癌は絶対にできません。正常細胞にp53の変異を導入しても腫瘍化しないことは、30年以上前に「ノックダウン・マウス」の研究など多くの研究がなされて確立した事実です。p53変異が意味を持つのは「癌化の後半のステップ」=Oncogene Stressによる細胞自殺の回避、の時です。通常の発癌では「遺伝子変異の蓄積」は数年をかけて進行しますがp53は「必ず後半(ポリープなら高度異型)」です(The Cell 20章1125)。
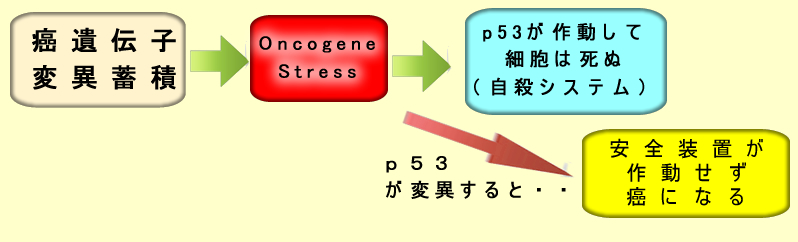
p53が早期変異した高悪性度・低分化癌は、必ず、その前に「短期間でのゲノムの大きな異常(カタストロフイ)」が起きていなければなりません。
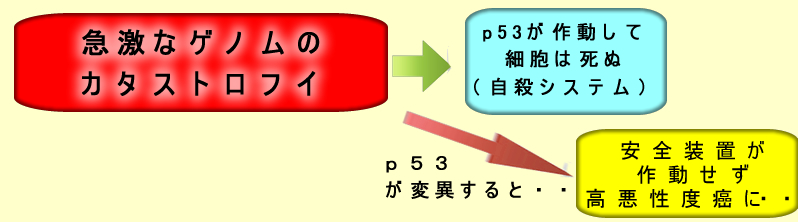
このような「急速癌」は「臨床的な取り扱いは、ほとんどDe Novoと同じだから、臨床的De Novoということでいいのではないか?」という意見も日本にはあります。しかし、これは「Two Step 」癌であり、厳密にはDe Novo(One Step癌)ではありません
では、最初の「短期間でのゲノムのカタストロフイ」の正体は何か?というと、これは「ゲノムの不安定性」により起きると考えれれています(⇒ゲノム不安定性と大腸癌)。現時点では、おそらくは「染色体粉砕」が、最も有力な候補です。「染色体粉砕」により「複数の癌遺伝子とp53が同時に異常」になればOne Stepですが・・・・かなりの偶然です。
慢性胃炎・食道炎はp53が異常(大腸の「高度異型腺腫」に相当する)
驚くべきことに慢性胃炎・食道炎の段階でp53が異常になっているという報告があります(胃炎,食道炎)。「血中p53抗体:陽性」で精査しても癌が見つからない方が多いのですが、恐らくは、胃炎・食道炎が原因と思われます。これが意味するのは次のようなストーリです。「我々が認識していなかっただけで、実は慢性胃炎・食道炎の一部は遺伝子変異が予想以上に酷く、大腸の高度異型腺腫に相当する」。今日では「癌は主に多段階発癌で発生する。厳密な意味のDe Novo癌は実在しないか極めて稀」と予想されています。
これは進化論的にも合理的です。我々は長い進化の間に「癌化を予防する安全装置(=癌抑制遺伝子。p53は、この典型)」を複数、身に着けたのだから簡単には癌化しない。細胞が簡単に癌化したら、我々は地上に生き残っていないだろう、という意見です。実際に培養細胞を癌化(Transformation)させる実験では下等な生物の細胞ほど癌化し易く、人の細胞は最も癌化しにくいです。「何故、癌が発生するのか?」よりも「何故、人は、こんなにも癌(DNA複製エラー)が少ないのか?」の方が分子生物学的な謎であると言われています(The Cell 20章 p1094)。
では、本当に「厳密な意味でのDe Novo大腸癌(One Step癌)」は実在しないのでしょうか?これが今回のテーマです。
遂に見つかった・・・人のDe Novo癌(One Step癌);軟部悪性ラブドイド腫瘍(MRT)
この癌はSMARCB1という、たった1個の遺伝子異常で発症することが確認された「正真正銘のDe Novo癌」です(2021年Review)。何故、たった1個の遺伝子異常が癌を起こすか?というと、この遺伝子は「クロマチンの再構成」に関与しているために「多数の広範囲の遺伝子に発現異常」を起こすからです。
| クロマチンとは何か?というと・・・・ 「人のDNAは全長2mで、これが6μmの核内に収まるのは40kmの細糸を絡まることなくテニスボール内に詰め込むのに等しい(The Cell4章p179)」。この「圧縮詰め込み」を行っているのがヌクレオソーム(ヒストン)です。遺伝子が転写される時は随時「圧縮が解除」される必要がある。このヌクレオソームの再構成を行うのがSWI/SNF /BAF複合体で、その核となるのがSMARCB1です(難しい話です・・)。 |
この癌は多くが「生後間もない新生児」に発生する、極めて悪性度の高い癌です。このような表現は不謹慎ですが、多くの場合は死産になるはずだったが、遺伝子変異の発生が、少し遅れたために死産にならなかったと言える「超急激な癌」です。
人の大腸にも軟部悪性ラブドイド腫瘍(MRT)の報告があります。多くは高齢者でありSMARCB1は正常で、CROCC(染色体の中心体)に異常が指摘されており、「新生児のMRTとは別の癌」と言えます(文献)。

次のDe Novo癌(One Step癌)の候補:MOB1
この遺伝子もSMARCB1ほどでは無いのですがYAP/TAZ経路を抑え「多様な遺伝子の発現」に影響します。この遺伝子の異常は実際の人の癌では見つかっていません。また、この遺伝子を異常にしたマウスは「致死的変異」で全て死産となります。神戸大学のグループが「生後のマウスでMOB1異常を意図的に誘導できる(Cre-loxPシステム)マウス」を作製しましたところ・・・・MOB1異常を誘発すると、僅か1週間で口腔癌が100%の頻度で発生しました。これは「世界最速の癌発症モデルマウス」と言われており「正真正銘のDe Novo癌(One Step癌)」です
このYAP/TAZ経路の異常は、人の大腸癌では「極めて稀」と報告されています。
今後、他の遺伝子でも、このような「一つの遺伝子変異が多くの遺伝子発現を変化させる」ような変異で「正真正銘のDe Novo癌(One Step癌)」が実験的に作製されていくと思われます。
