では・・・子宮頸癌以外の癌で「予防ワクチン」は荒唐無稽な夢なのでしょうか?
通常、「癌ワクチン」と言う用語は進行した癌を対象にする「治療ワクチン」です。これは「Neo-Antigen理論」を元にしています。
古典的な癌免疫のモデル・・・・Neo-Antigen理論
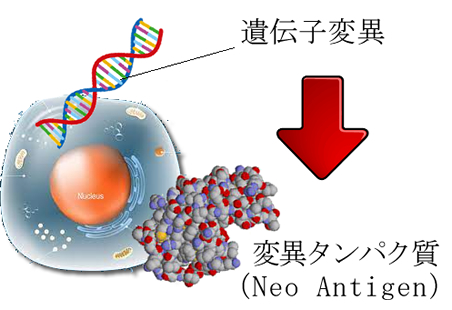
癌は変異した遺伝子から作られる変異したタンパク質(Neo-Antigen)を持っており、これが免疫の攻撃対象であるというモデルです。MSI(マイクロサテライト不安定性)有りの大腸癌は免疫療法(オブジーボなど)が、著効します。これはMSI癌はNeo-Antigenが豊富だからです。Tumor mutation burden (TMB) が高い、とも表現されます。
MSI陰性の癌も量が少ないだけで、確実にNeo-Antigenが発現しています(変異した遺伝子があるから当然)。しかし免疫療法が効きません。発現量の少ないNeo-Antigenには「免疫的な寛容」が成立しているからです(2022年Nature)。高齢者の正常細胞には多様な遺伝子変異が蓄積し、Neo-Antigenが発現しています(2019年Nature)が、これらの抗原は全て免疫的に「寛容」になっていることを考えれば「当然の現象」とも言えます。
では、なぜNeo-Antigenに寛容になってしまうのでしょう?
異物(抗原)とは何か?
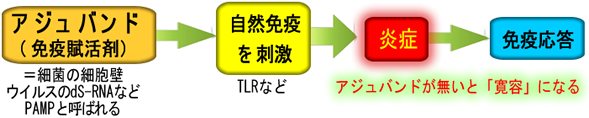
例えば旅行して「生まれて初めての魚を食べる」場合、口から大量の「Neo-Antigen」が入ってきます。しかし免疫反応は起きません(起きたら食物アレルギーです)。実は、意外な話ですが・・・「Neo-Antigen(抗原)が、体内に入った場合は免疫的寛容が起こる」のが原則です。抗原と一緒にアジュバンド(免疫賦活剤)が投与された場合にのみ、免疫系は「敵だ!」と認識し免疫反応がおきます(この驚愕の事実は、2011年にノーベル賞を受章しました)
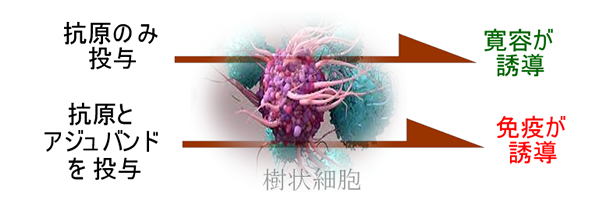
アジュバンドの正体は自然免疫系(TLRなどと呼ばれます)を刺激して炎症反応を起こすという「炎症誘起剤」です。「免疫着火剤」とも言えます。これが「この抗原は有害な敵だ!」というシグナルになり免疫が起動します。このシグナルが無いと「寛容」になります。これが2011年のノーベル賞研究「自然免疫」の内容です。細菌やウイルスは「天然のアジュバンド(PAMPと呼ばれます)」を持っています。しかし「初めて食べる魚」にはPAMPが無いので炎症が起きません。その結果、免疫反応は起きず寛容になります。
癌治療ワクチン(ペプチドワクチン)の成功
最近、食道癌の臨床試験で生存期間の延長が確認され注目されていいます(2022年近畿大学)。尚、抗原は「腫瘍精巣(又は胎児)抗原」と呼ばれるもので「正常組織での発現は精巣(又は胎児)に限られる」という抗原です。変異した遺伝子に由来する「真の」Neo-Antigenでは、ありません。「真の」Neo-Antigenは、同定するだけでも大変な作業で臨床応用はまだ先です(遺伝子を調べてNeo-Antigenを見つけのは容易です。しかし実際に癌細胞がそのNeo-Antigenを細胞表面にMHCクラスⅠ提示していないと攻撃対象になりません)。
カギは抗原ではなくアジュバンド(炎症反応)
食道癌でワクチン治療が成功しましたが、本来「免疫的な寛容」が成立しているはずのNeo-Antigenへの攻撃が何故、起きたのでしょう?これは抗原(ペプチド)と一緒にアジュバンドを投与したからです。アジュバンドが「免疫的な寛容」を打破する鍵で、「抗原(ペプチド)を何にするか?」より重要と言えます。しかしアジュバンドは強いと自己免疫疾患の危険があります。近年、STING経路などアジュバンドの研究が進歩していますが、まだまだ試行錯誤での投与です。ここがNeo-Antigenワクチンが苦戦している最大の理由です。
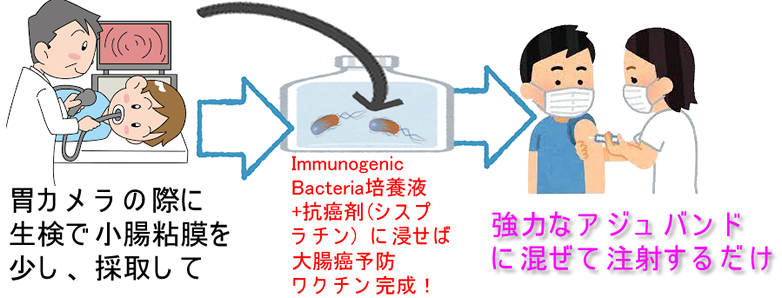
癌予防ワクチンは可能か?
未然に癌を防ぐには、将来、癌がどのようなNeo-Antigenを発現するかを「予測」しなければいけません。これは不可能に近いです。したがってNeo-Antigenを利用する「癌予防ワクチンは特別な例外を除くと開発不可能」という結論になります。
「特別な例外」はMSI(マイクロサテライト不安定性)を起こす遺伝性大腸癌=リンチ症候群(HNPCC)の場合です。変異が「フレーム・シフト型変異」が多く、パターン化されているので、「将来、発生しうるNeo-Antigen」が予測可能となります。従って「癌予防ワクチン」が理論的に可能です(2021年Review)。この仮説に基ずく「フレーム・シフト型ワクチン」はマウスの実験では成功しており(2021年)、現在は治験がフェーズⅡまで進んでいます(2020年)。
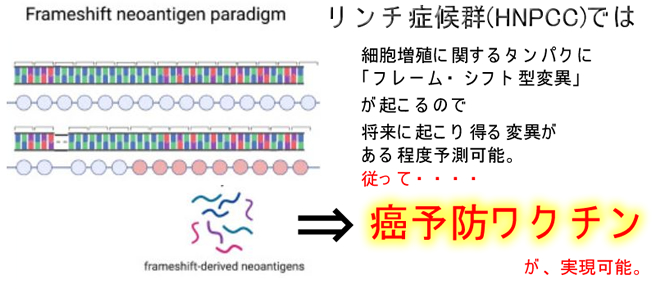
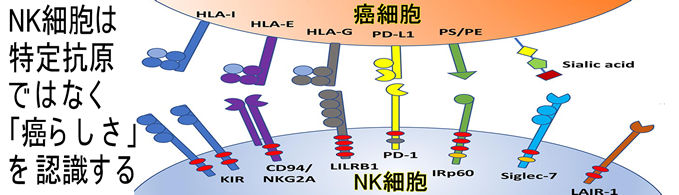
HNPCCのような特別な場合でなくとも、Neo-Antigenを必要としない癌免疫は実在します。有名なNK細胞(ナチュラル・キラー)は、癌を認識する時にNeo-Antigenを必要としません。Neo-Antigeが無くても癌には「癌らしさ」があり、NKは、これを認識します。NKならば理論的に「Neo-Antigen不要の癌予防ワクチンが可能」です。但しNeo-Antigenを使うワクチンより遥かに効率の悪いワクチンです。これは「BCG(結核菌ワクチン)が新型コロナウイルスに予防効果がある」という以前、騒動になった話と似ています。
Neo-Antigenに変わる「Danger Hypothesis」理論・・・我々の免疫系は異物ではなく「危険」を認識している
この仮説は2002年に初めて提唱されました。Stress抗原とも呼ばれます。
以下の二つの重要な文献が今回の記事の主旨になります。
文献(1)2022年Nature Review Immunogenic cell stress and death
文献(2)2020年Nature Chemotherapy-induced ileal crypt apoptosis shape immunosurveillance of colon cancer 詳細なReview 要約
実は過去に文献(2)を当サイトで取り上げていますが、当時は難解な内容で完全には理解できず、(1)2022年のNatureの記事を読んでから改めて重要性に気付き、今回、再び取り上げる次第です。
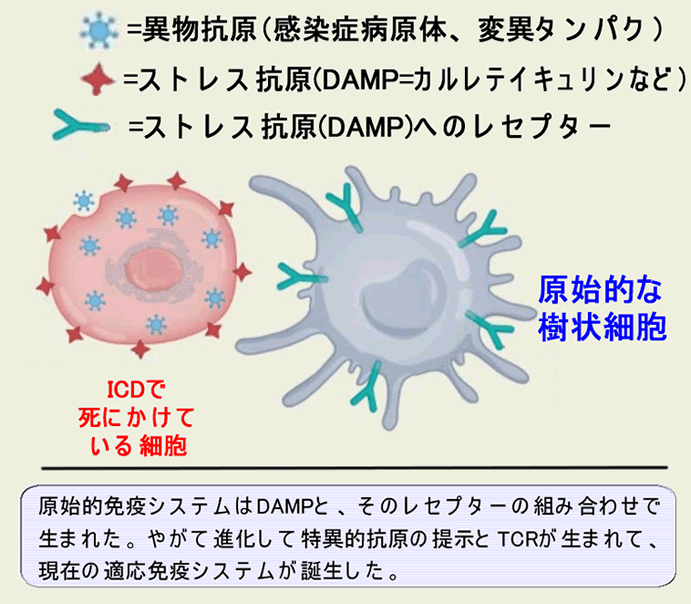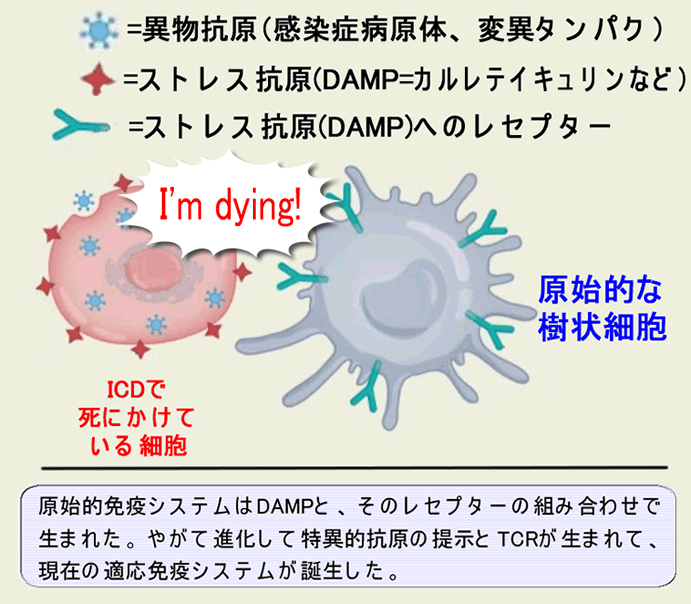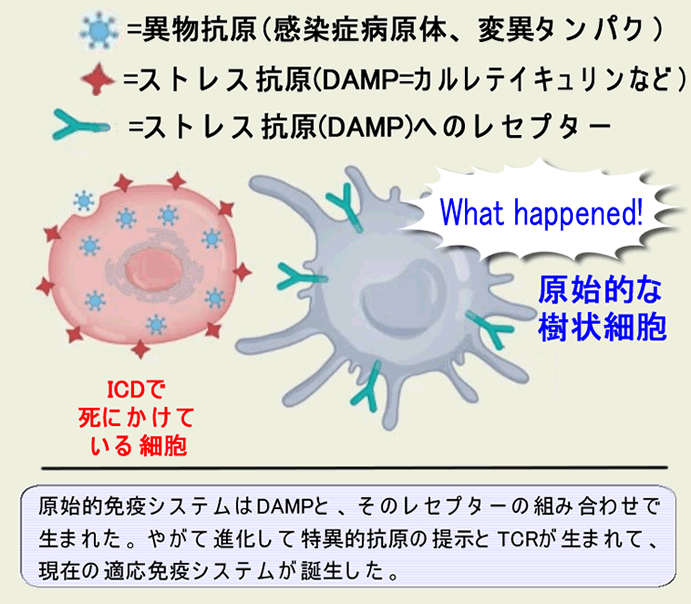
| (専門的)Danger Hypothesisモデルの概要(下図) 細胞は老化などの自然な死(ストレスの無い死)では、周囲に免疫反応を起こさないように、サイレントに死にます(=アポトーシス)。しかし、感染や有毒物質、変異蛋白の蓄積、などで病的な死(ストレスの強い死)では周囲に危険を警告するためにDAMP(Damage Associated Molecular Pattern)を放出します。これが炎症を誘起し免疫反応を起こします。このような死をICD(Immunogenic Cell Death)と呼びます。 最も基本となる重要な「ストレス抗原=DAMP」は「カルレテイキュリン」で、通常の細胞死では発現せず、ICDに特異的で「Eat Me」シグナルとなります。これに次ぐ重要な「ストレス抗原」はHsp(熱ショッタンパク)やATPです。低分子のATPは広く拡散し「Find Me」シグナルとして免疫細胞に働きかけます。更に「ウイルス感染擬態」が起きればインターフェロンが放出されます。 |
| 解り易く言いますと 感染した細胞は「敵だ!」というシグナル(DAMP)を拡散しながら死ぬ(ICD=Immunogenic Cell Death)。これが炎症反応。癌細胞も変異蛋白の蓄積で死ぬ時に、変異蛋白をウイルス感染と誤認して、ICDを起こす。 |
ICDの詳細は文献(1)にありますが、深入りせずに本題に入ります。

以下、このような3つの例を挙げますが、いずれも「抗原の正体」は未確認です。癌細胞と「ストレス死した正常細胞」が同じ遺伝子変異を持つ可能性はゼロなので、「Neo-Antigen」ではないことは確かです。通常は正常細胞は発現しない「腫瘍精巣抗原」のようなタンパク質を、ストレス死する際に正常細胞も発現するのかもしれません。あるいはストレス死する正常細胞が発現する「ストレス抗原」を癌細胞は恒常的に発現しているのかもしれません(癌化という現象がストレスなのでしょう)。あるいはNK細胞が認識するような「癌的な特質」がストレス死でも発現するのかもしれません。
現時点では分子的機序は未解明で、ただ「免疫効果が確認された」という現象の報告です。しかし(1)2022年のNature Reviewでは「These examples suggest that ,Stressed Non-transformed cells can elicit Tumor-targeting Immune Responses」と称賛しています。Neo-Antigenを同定することは大変な作業ですが、これが「ストレス死した正常細胞」で代用できるなら画期的だからです。
<1>2020年 正常な乳腺上皮細胞を抗癌剤で「ストレス死」させた死骸は「乳癌予防ワクチン」になるという報告がありました(本文中の記載 Importantly, injection of organoids from the normal breast epithelium optionally treated with MTX or radiation therapy (another inducer of immunogenic cell death)had a similar capacity to delay M/D-driven oncogenesis の部分です)
<2>2021年 自己免疫疾患は通常は「慢性炎症⇒発癌」という経路で発癌を促進します。実際にPSCという自己免疫性胆管炎は胆管癌の発生が多いです。所が、同じ自己免疫性胆管炎でもPBCという病態では胆管癌の発生は極めて稀(健康人よりも稀)です。また実験的にPBCを発症したマウスは「胆管癌細胞の移植」を拒絶します。つまり自己免疫によりICDを起こした正常胆管細胞が胆管癌ワクチンになった訳です。
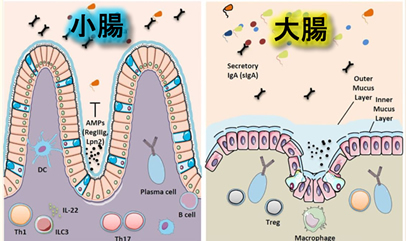
<3>2020年 抗癌剤でストレス死した「正常小腸細胞の死骸」が大腸癌の予防ワクチンになると報告されました。「何故、小腸なのか?」という疑問への答えを以下に列挙し解説します。