始めに
RNAワクチンで有名なカリコ博士は、もともとは遺伝子治療が専門で自然免疫をトリガーしない(PAMPの無い)、デリバリーRNAとしてシュード・ウリジンRNAを開発しました。これをPAMP活性の強いLNP(脂質ナノ粒子)と組み合わせてワクチン化した訳です。
LNPはRNAワクチンの核心部分で(1)RNAの分解保護(2)エンドサイトーシス促進(3)エンドソームを破壊し細胞質への脱出(4)PAMP活性(正確にはDAMP)、の4つの働きをします
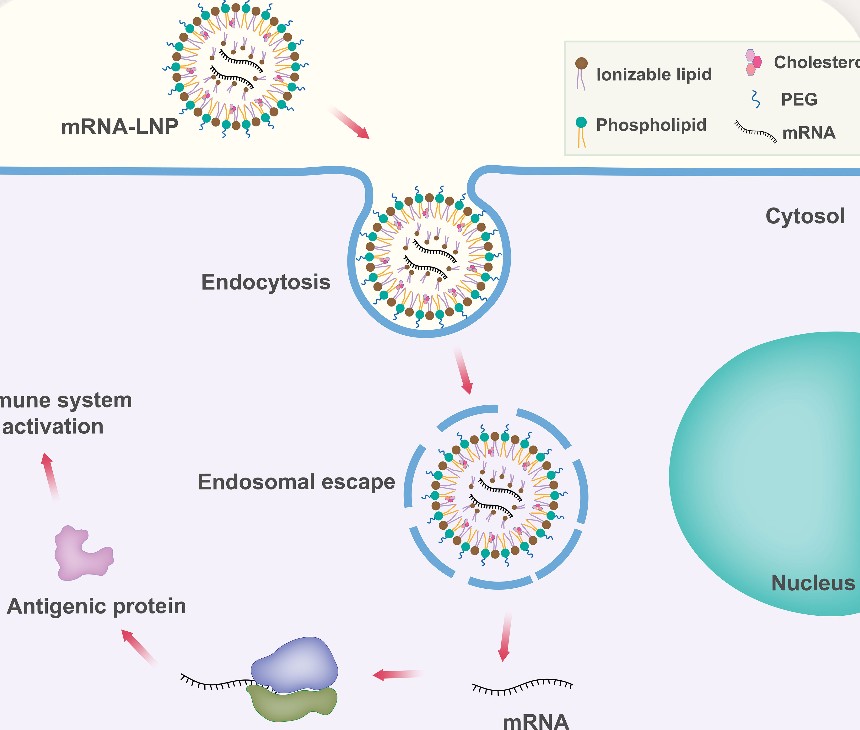
RNAワクチンには致命的な欠陥があります。免疫応答には自然免疫系(TLR)の賦活(炎症)が不可欠(アジュバンド、PAMP)だが、これは翻訳停止(elFリン酸化などのストレス応答;ISR)を引き起こすというジレンマです。この構造的欠陥から、Covidでは緊急避難的に使われましたがRNAワクチンが使われることは二度と無いでしょう。LNPの組成を変えて「PAMP活性の無いLNP」に変更すれば、ワクチンでは無く(免疫応答を起こさない)、デリバリーRNAが完成します。
今後はRNAはワクチンでは無く、Drug Delivery(本来のカリコ博士の研究)にシフトし医学に大革命を起こすでしょう。
その先陣とも言える驚愕研究が2025年米国Capstan Therapeutics社からありました。何とRNAを個体に投与して固体内のT細胞をCAR-Tに変換してしまう!という研究です(RNAなので効果は一時的です)。サルでの前臨床実験は大成功です。CAR-TはB細胞白血病だけでなく「自己免疫疾患を根治する治療」として注目されていますが、現行では1回3千万円かかります。しかし。この方法なら数万円で自己免疫疾患を根治できるでしょう!今、当に革命が起きようとしているのです!

最大の障壁は「RNAはTLRを刺激し炎症を起こす」点なのですが「炎症を起こさない修飾RNA」がカリコ博士のシュード・ウリジン以外にも多く開発中です。
RNAワクチンの筋肉注射やリンパ球へのRNA導入は技術的に障壁は少ないです。
しかし、消化管(特に大腸)の上皮細胞へのRNAデリバリーには多くの障壁があります。
(1)胃酸による分解
(2)消化液の中の豊富なRNA分解酵素。これは栄養として分解する意義と病原体RNAを分解する意義があります。
(3)外部RNAを敵とみなす強力な免疫系(TLR)。消化管の中は細菌、ウイルスが豊富なので当然の話
(4)腸壁の表面を覆う厚い粘液層(小腸は薄いが大腸は厚い)
(5)小腸の吸収上皮はエンドサイトーシスが活発だが大腸は活発でない。そもそも大腸は容易に外部RNAを取り込んでいたら病原体に感染してしまう訳で、外来RNAの侵入には「強いバリアー」を持っている
これらの理由から「大腸へRNAデリバリーは不可能」と言われていました。しかし、最近、この難壁に挑む研究が多く出てきて「臨床応用・前夜」となっています!
特殊なカプセルで障壁を乗り切る
2025年に大型の動物(豚)の大腸炎の治療が成功しました(Oral delivery of liquid mRNA therapeutics by an engineered capsule for treatment of preclinical intestinal disease)。胃酸からRNAを保護するカプセル(中性の腸内ではRNAを放出)にIL-10のmRNA/LNPを封入し「動物の腸炎の治療」に成功たという内容です。
専門家は、この報告を「消化管へのRNAデリバリーの大きな転換点であり、事実上の前・臨床試験」と見ているようです。
植物由来EV(Extracellular Vesicle)で障壁を乗り切る
ブログ記事植物のRNAが我々の細胞を変えるで紹介しましたが「トランス・キングダムRNA干渉」という現象が話題です。植物由来のマイクロRNAが直接、またはEV(細胞外小胞)を介して我々の細胞に取り込まれる。多くは我々に有益な働きをしている(我々がその方向に進化した)、という驚愕的な説です。
ショウガ、ブドウ、茶葉、ニガウリ、ブロッコリーなどの由来のEVが研究されました。特にショウガ由来EV(GDNP)が大腸上皮と親和性が高いようです(文献1、文献2)。植物から抽出する天然EVは、安定供給に難があるために「植物EVと同じ成分(糖鎖)を模倣したLNP」が多数開発されています(2025年レビュー)。

マイクロニードル・カプセルで障壁を乗り切る
美容液を皮膚に染み込ませる「マイクロニードル・パッチ」が商品化されていますが。この技術を「消化管デリバリー・カプセル」に応用する研究が進んでいます。このようなアプローチは「厚い粘液層を突破してRNA/LNPを届ける」手段に使われます。細胞に直接ニードルを指してRNAを細胞質へ注入できれば理想的ですが、粘液層の厚さが一定では無いので現実的には無理で「細胞外の間質」へデリバリーします。
更に最近は磁石を使って体外からニードルを露出させるというデバイスも開発されました。
Magnetically triggered ingestible capsule for localized microneedle drug delivery
大腸菌や真菌で障壁を乗り切る
遺伝子組み換え大腸菌を腸へのDrug Deliveryに利用する研究が盛んです。例えば「抗TNF抗体を分泌する大腸菌」でIBDを治療するという報告があります。現在、人への臨床試験が進行中とのことです(結果は未発表)。遺伝子組み換え大腸菌は腸内で安定して定着することも報告されました。またDrug Deliveryではないのですが遺伝子組み換え大腸菌の人への投与はオーストラリアで「100名に投与し5年間の追跡」で安全性が確認されました(記事)。
では大腸菌でRNAデリバリーは可能でしょうか?
大腸菌にも「マイクロRNA様の短いRNA(msRNA)があり、EV様の小胞(OMV=Outer Membrane Vesicle)を使って菌体外へ分泌します。そして、これを腸の上皮が(腸管マクロファージではありません!)、盛んに取り込んでいる現象が報告されています(文献1,文献2)。従って組み換え大腸菌はRNAデリバリーの有力候補と言えます。但しOMVの表面にはLPSがあり、強い炎症誘起性がネックです。
では真菌でRNAデリバリーは可能でしょうか?
真菌もEV様小胞(Fungal EV)でRNAを放出します。そして植物は真菌からマイクロRNAのみならず完全なmRNAを受け取り「トランス・キングダムRNA干渉」を積極的におこなっています。これを農業分野に利用した「真菌RNAスプレー」も開発中です(2023年レビュー)。
しかし人では・・・・Fungal EVは細菌OMVよりも炎症誘発性は低く、腸上皮と親和性の高い糖鎖を持っており、組み換え大腸菌以上に有力な候補と言えます。しかし現時点でFungal EVから真菌RNAを腸上皮が取り込んだ現象は報告されていません(理由は謎です)(2022年レビュー)
ウイルスベクターで障壁を乗り切る
遺伝子治療に使われるウイルスベクターには常に「安全性(特に発癌性)」の懸念が付きまとい、これが臨床応用への最大の障害でした。しかしCovidのパンデミックは、この壁を一瞬で吹き飛ばしました。
「サルのウイルスを人に投与する」という従来なら絶対にOKされない新技術が数億人に投与されるという「史上最大の遺伝子治療実験」が行われたのです。これが英国アストラゼネカ社のChAdOx1(サルアデノウイルスベクター)です。
血栓症という副作用は見られましたが頻度は極めて低く(10万人に一人)、最も懸念された「発癌性」の問題も今のところ報告されていません。つまりChAdOx1の安全性は証明されたということです。
つまり、これが今後の遺伝子治療のスタンダードになるという意味です。
特に腸管はヒトアデノウイルスへ強い粘膜免疫を持っていますから「人アデノウイルス・ベクター」は使えません。しかし猿のウイルスであるChAdOx1なら腸管にも使えます。
しかし免疫原性が強いので「反復投与」は効率が落ちるでしょう。その点では、遺伝子治療に広く使われているAAV(アデノ随伴ウイルス。免疫原性が低い)が優位かもしれません。
