今回の内容はここ1〜2年で急速に研究が進んだ話です。「大腸癌は薬で治る時代」は、もうすぐかもしれません!
- MSI陽性の癌は手術不要。免疫療法で根治する
- MSS型癌を人為的にMSI型に変える戦略
- 神経保護剤として開発されてきたSIRT2阻害剤
- 「遺伝子編集」の研究でMLH1阻害剤の研究が進む
- 最新AIが創薬したMLH1阻害薬
- 生理的なMLH1阻害剤 miR-155
- 染色体不安定型癌への「合成致死」
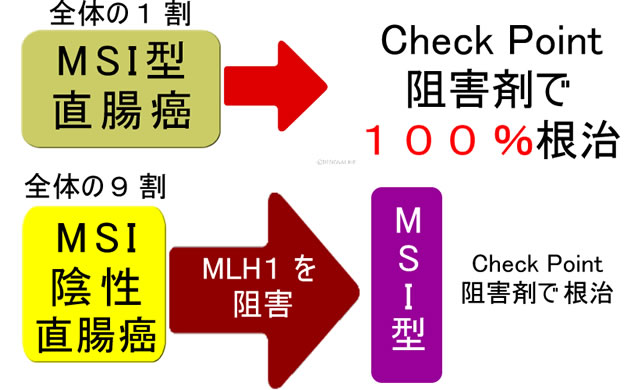
MSI陽性の直腸癌は手術不要。免疫療法で根治する
2022年NEJM誌に、MSI陽性の直腸癌(進行癌です!)が手術せずともオブジーボなどの免疫チェックポイント阻害剤(ICI)で、100%近く根治すると報告されました。更に2025年のNatureの報告では直腸以外の癌でも平均すると65%がICIのみで根治します(特に尿路系や肝胆道が効きやすい)。興味深いことにPD1/PDL1の発現量は治療効果に、あまり影響しません(癌での発現よりも免疫細胞での発現が重要)。MSIの程度(ゲノム不安定性の程度)が強いほどICIが効きやすいです。つまりリンチ症候群の方なら「家系に癌の方が多く」「本人も癌が多発」する場合ほどICIが効く可能性が高いと予想できます。
尚、直腸以外の結腸は調査されていません。理由は、「手術の侵襲の強い直腸癌に長期に(数か月)ICIを投与して手術を回避できないか?」を調べた研究だからです。結腸は外科手術の手術侵襲が小さいので「短期間のICI治療+手術」が既に確立しており、この研究の対象ではありません。しかし短期間のICI治療だけでもMSI型結腸癌の根治率は70%前後なので、おそらくMSI型結腸癌も長期のICIで100%近く根治すると予想されます。
MSS型癌を人為的にMSI型に変える戦略
しかし大腸癌でMSI陽性は1割ほどです。9割はMSI陰性(MSS)です。MLH1というDNA修復酵素に異常があるとMSI陽性になります(リンチ症候群の方は先天的にMLH1が異常です)。「それなら人為的にMLH1を抑制すればICIが効くようになるだろう」という研究が2025年のScienceに報告されました。
プロテオーム解析がSIRT2阻害剤を見つける
研究者はまず、「免疫原性の強いMSI癌」でタンパク質の発現を網羅的に調べました。そしてSIRT2というタンパクが低下していることを見つけました。そして「SIRT2阻害剤がMLH1を阻害する」ことを発見しました。
神経保護剤として開発されてきたSIRT2阻害剤
実はSIRT2阻害剤は神経保護剤として既に臨床応用を目指して開発が進み、市場投入が間近の薬でした(⇒京都府立医科大の研究)。尚、この神経保護作用はMLH1阻害とは全く関係はありません。完全な偶然です。
ここまで読まれたら方なら、気付くでしょう。「ではAIでスクリーニングすれば、新たなMLH1阻害剤が見つかるのではないか?」と。
「遺伝子編集」の研究でMLH1阻害剤の開発が進む
実は別な分野で「MLH1阻害剤」のスクリーニングは続いていました。2019年に開発された「プライム遺伝子編集」という新しい技術は従来の遺伝子編集の精度を大幅に向上させる技術です(⇒2025年の臨床応用)。MLH1は、この技術の障壁でした。人工的に編集したDNAを「変異だ!」と認識したMLH1が「修復」してしまうからです。それで2022〜23年ごろ「MLH1阻害剤を併用することでプライム遺伝子編集の効率を上げようという研究が始まりました。
そして2025年Cellに、韓国が「生成AI(RFdiffusion)を使いMLH1を阻害するペプチドの新規合成」を報告しました。言うまでも無く、この新規分子は「MSI陰性癌を人為的にMSIに変更する」戦略にも使えます。これ以上の他のMLH1抑制剤を最新AIが見つける可能性もあるでしょう。
短期間に複数の研究が「合流」!
生理的なMLH1阻害剤 miR-155
これらの研究の中で我々の体内にはMLH1を阻害するマイクロRNA(miR-155)が見つかりました。なぜDNA修復酵素を積極的に阻害するのか?その生理的意義は?miR-155は幼若なリンパ球で発現していることからDNAの変異による免疫・多様性の獲得に関与していると思われます。本庶博士が発見したAIDは「体細胞突然変異」を起こすことで多様性を生み出しますが、MLH1は、これを「修復」してしまうのでMLH1を阻害した方が突然変異の効率が上がる訳です。つまり「プライム遺伝子編集」に人工の「MLH1阻害剤」を組み合わせるのと全く同じ戦略を細胞は本来、持っていた訳です。
加齢で正常組織に見られるMLH1機能低下
miR-155は幼若なリンパ球で発現しますが、これとは別に高齢者の大腸では、しばしばMLH1が不活化しています。これが右側大腸癌(SSAP由来のCMS1型大腸癌)の原因です。この不活化は「プロモーター領域のCGがメチル化されること」が原因です。通常はDNA修復酵素のような「ハウスキーピング遺伝子」のプロモーターはメチル化から保護されています。なぜMLH1のプロモーターは加齢でメチル化されるのか?実は、よく解っていないのですが「生理的な意義は無く、エラーの蓄積(ノイズ)だろう」と予想されています。つまりDNAをメチル化する酵素は精度が低く、細胞分列の度にメチル化は「不正確に」継承されます。腸の細胞は人体で最も細胞分裂回数が多いので単純にエラーの蓄積(ノイズ)が多いのだろうという解釈です。
この現象は「薬剤でMLH1を抑制しても直ちに重篤な副作用が見られる訳ではない」ことを意味します。
合成致死とICI
IMSI−L癌も決してゲノム不安定性が無いのではない。染色体不安定性、点変異などの他のゲノム変異は蓄積している。これに「MLH1阻害」を加えることは「合成致死」と同じ効果を産みICIへの感受性を大きく上げることが理論的に予想される。
ではBRCA変異乳癌に「PERP阻害剤+ICI」の「合成致死+ICI」の効果はどうなっているか?現在、MEDIOLA試験が進行中で高い奏効率が報告されている。この試験では免疫関連有害事象(irAE)は懸念されたほどはひどくはなかったようだが、今後は癌へのDrug Delivary(局注)も研究されるだろう。消化器系では内視鏡を使ったDeliveryが研究されるでしょう。免疫療法なので全ての癌細胞にDelivaryする必要は無く、モザイク状にDelivaryできれば十分です。
これはCMS4型大腸癌やPDAC(膵癌)、,TNBC(3重陰・性乳癌)などの「難治性・超悪性度癌」の治療の可能性を開くものです。
