このページは完全に専門家向けです
過形成ポリープのリスクについて
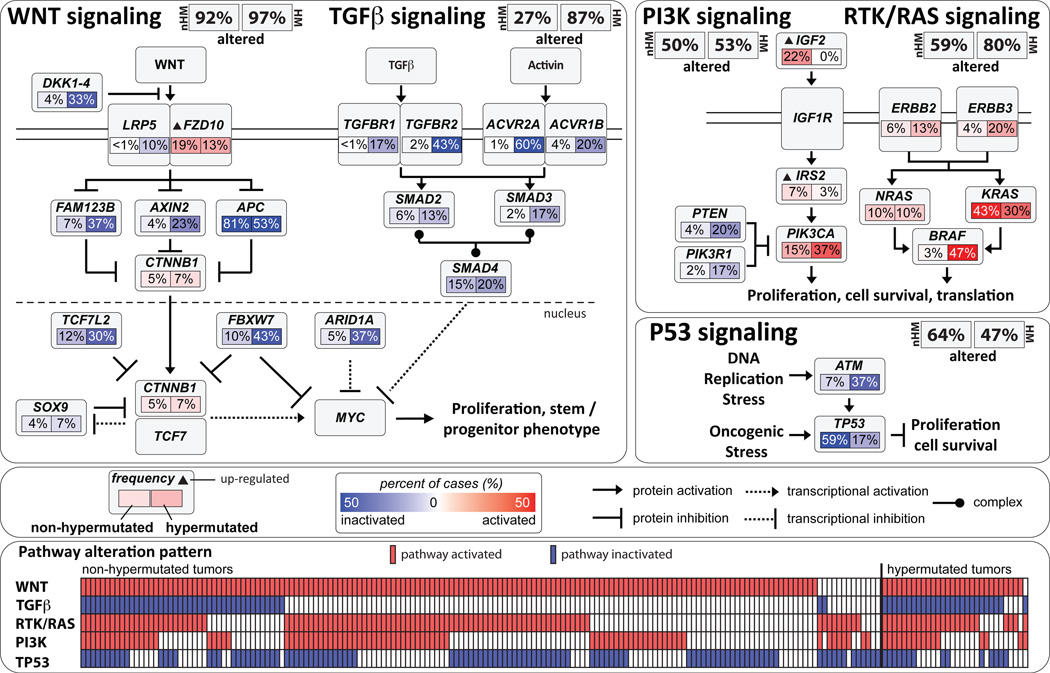
2012年のTCGAプロジェクトにより全ての大腸癌の発生には(1)WNT系の異常(2)増殖因子シグナル伝達系(EGFR、RAS,RAF,他)の異常(3)PI3K系の異常(4)TGFβ系の異常(5)p53系の異常の「5つのシステム異常」が、「ほぼ必須」の要件であることが確認された。
この「5つのシステム異常」は、どの順番で起こるか?は全く、偶然によるもので、どのような順番でも起こる。Adenoma/Carcinoma Sequenceの話から(1)が最初に起こると考えている臨床医も多いが、言うまでもなく、これは初歩的な誤解である。実際には5P5=5×4×3×2×1=120通りの組み合わせがある。現実には120種類のポリープ(前癌病変)が存在するのに、無知な我々が強引に「腺腫」「過形成」「過誤腫」とカテゴリーに分けているのに過ぎない。
(1)が最初に起こると「腺腫」と呼ばれる(核異型有り)
(2)が最初に起こると「過形成ポリープ」と呼ばれる(核異型無し)
(3)が最初に起こると「過誤腫」と呼ばれる(核異型無し)
(4)や(5)が最初に起こる腫瘍も存在するはずだが、我々は知らない。これらの変異は細胞増殖の亢進を起こさないので我々は単純にポリープとして認識できないだけなのだろう。あるいは、そのような細胞はやがて老化により自然脱落するので意味は無いのだろう。
腺腫が癌化するリスクと過形成が癌化するリスクの比較は
(1)が最初に起きたポリープに(2)の変異が追加されるリスクと
(2)が最初に起きたポリープに(1)の変異が追加されるリスク
の比較に、対応する訳であるが、後者を過小評価することは分子生物学的に根拠が全く無い
(1)の変異が(2)の変異より確率的に起きにくいという証拠は無く、むしろ腸管細胞は(1)の変異が起きやすい(APCが巨大タンパクであり、WNTが複雑で巨大なシステムだから)と考えるべきである。実際に過形成ポリープは癌化の最終段階でWNT系の異常が高頻度で見つかる
2015年のCMS分類会議の結果では過形成由来・癌はCMS1+4=37%、腺腫由来・癌はCMS2+3=50%であり「数は腺腫由来の方が多い」ため、どうしても臨床的に「腺腫は過形成ポリープより癌化しやすい」という印象を受けるのだが「予後は過形成由来・癌(特にCMS4)の方が圧倒的に悪い」(下図)
(1)はM期のcheck point異常を起こすためにchromosome instability(SCNA)を起こし「核型」が異常になる。これはAPCがM期の染色体分裂に関与するからである
(2)はmismatch repair異常(多くの点変異)やメチル化でゲノム全体に異常を起こすが(ここの機序は十分、解明されていない。)、chromosome stableで「核型」は正常である。
このため細胞異型・核異型・構造異型などの形態を重視する画像病理では腺腫のリスクが過大評価され、異型の無い過形成ポリープのリスクが過小評価される
しかし細胞異型・核異型はM期check pointの異常を見ているだけであり、構造異型も細胞極性の乱れを見ているだけであり、これらはTransformationの本質ではない。Transformationの最大の本質はG0/G1check pointの異常であり、これだけでは異型が起きない。
例を挙げるとBRCA異常ではchromosome unstabeであるから遺伝性乳癌の人に発生したポリープのリスクは過大評価されるが、MLH1異常はchromosome stableであるから遺伝性大腸癌(HNPCC)の人に発生したポリープのリスクは過小評価される訳だが・・・言うまでも無く、真実は全く逆である
一例を示す
横行結腸の病変であるが、色素散布がルチーン化した今日では「日常的に遭遇するありふれた病変」となった。このような過形成病変は「SSAPの診断基準」を満たさないために病理診断が混乱する。「過形成ポリープ」「中間型鋸歯状病変」「Sessile Serrated Lesion」などに診断が分かれ、時に「正常粘膜」という病理診断が出ることもある。Serrated Lesionの病理診断の不正確さは、病理の専門医の間でも問題視されている。
しかしながら重要なのは「異型を重視した病理診断」ではなく、この腫瘍はG0/G1check pointが破綻し、周囲のcontact inhibitionを跳ね除け、tellomere短縮による細胞寿命を跳ね除け「モノクローナルな制御されない細胞増殖」を続けているという事が内視鏡所見から十分に予測されるという点である。周囲にできている「しわ」を見れば、この腫瘍は周囲正常粘膜を押しのけて増殖を続けていることが解る。今は狂暴ではないが、やがてメチル化でMLH1に障害が起きれば遺伝子変異が蓄積され、WNT系にも異常を来たし、癌化へと進むと予測される。
実際の症例で言うなら、「CFで複数の過形成ポリープのみ(SSAPで無ければSPSでも無い)と診断したケースに翌年、1cmの早期癌が見つかりEMRで根治。その後10年、フォローしているが腺腫の発生は1個も認めず、過形成ポリープの切除を繰り返しているが癌の新生も見ない」という症例を複数、経験している。経験を積めば多くの内視鏡専門医が同様の経験があるはずである。
2012年の米国のガイドラインは「Proximal Hyperは微小な物も全て切除すべき」となっているが、これはCMS1癌(BRAF変異、MSI陽性、Hyper-Mutated type)を想定したものである。例え微小な物でも右側の過形成ポリープはCIMPが高率に見られることから「SCNAを起こした腺腫と同じく危険な病変である」という考えである。大腸癌の全遺伝子解読(TCGAプロジェクト)が完了したのが2012年。ほとんどタイムラグを置かずに、この内容を取り入れたガイドラインを2012年に出した米国の「早さ」には脱帽するばかりである。我々も、旧来の核異型を重視した病理診断の呪縛から解放されるべきであると考える。
文責 本郷メデイカルクリニック 鈴木